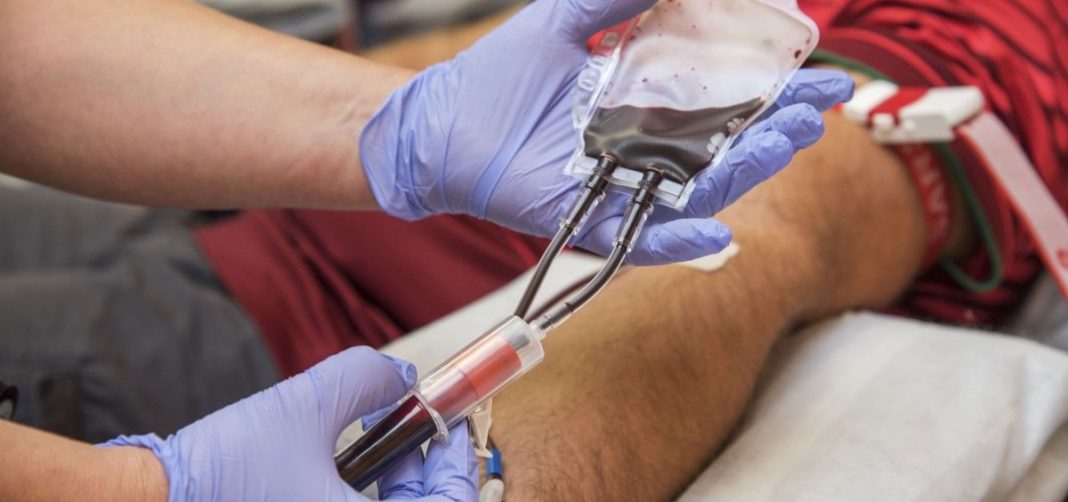
A través del Decreto Supremo 017-2022-SA, modifican el Reglamento de la Ley que declara de orden público e interés nacional la donación de sangre.
Aprueba modificación del Reglamento de la Ley N° 26454, Ley que declara de orden público e interés nacional la obtención, donación, conservación, transfusión y suministro de sangre humana aprobado mediante Decreto Supremo Nº 03-95-SA y modificado con Decreto Supremo N° 004-2018-SA
DECRETO SUPREMO Nº 017-2022-SA
EL PRESIDENTE DE LA REPÚBLICA
CONSIDERANDO:
Que, la Ley N° 26454, Ley que declara de orden público e interés nacional la obtención, donación, conservación, transfusión y suministro de sangre humana, declara de orden público e interés nacional la obtención, donación, conservación, procesamiento, transfusión y suministro de sangre humana sus componentes y derivados;
Que, el Decreto Supremo N° 03-95-SA, que aprueba el Reglamento de la Ley N° 26454, modificado con Decreto Supremo N° 004-2018-SA, regula las actividades de obtención, donación, conservación, transfusión y suministro de sangre humana, sus componentes y derivados; así como los aspectos de supervisión, fiscalización y monitoreo de las mencionadas actividades; con el fin de proporcionar sangre segura, en calidad y cantidad necesarias;
Que, con el propósito de mejorar la obtención, donación, conservación, procesamiento, transfusión y suministro de sangre humana, es necesario aprobar la modificación del Reglamento de la Ley N° 26454, aprobado mediante Decreto Supremo Nº 03-95-SA y modificada con Decreto Supremo N° 004-2018-SA, que establezca las condiciones técnicas y sanitarias para el funcionamiento de los Bancos de Sangre;
De conformidad con lo dispuesto en el numeral 8 del artículo 118 de la Constitución Política del Perú; el Decreto Legislativo N° 1161, Ley de Organización y Funciones del Ministerio de Salud, modificado por la Ley N° 30895, Ley que fortalece la función rectora del Ministerio de Salud y el Decreto Legislativo N° 1504, Decreto Legislativo que fortalece al Instituto Nacional de Salud, para la prevención y control de las enfermedades; así como, el Reglamento de Organización y funciones del Ministerio de Salud, aprobado por Decreto Supremo N° 008-2017-SA, modificado por el Decreto Supremo N° 011-2017-SA y el Decreto Supremo N° 032-2017-SA;
DECRETA:
Artículo 1.- Objeto
El presente Decreto Supremo tiene por objeto modificar el Reglamento de la Ley N° 26454, Ley que declara de orden público e interés nacional la obtención, donación, conservación, transfusión y suministro de sangre humana, aprobado por Decreto Supremo N° 03-95-SA y su modificatoria
Artículo 2.- Modificación de los artículos 13, 14, 45, 46 y 47 del Reglamento de la Ley N° 26454, Ley que declara de orden público e interés nacional la obtención, donación, conservación, transfusión y suministro de sangre humana, aprobado por Decreto Supremo N° 03-95-SA y su modificatoria
Modifíquese los artículos 13, 14, 45, 46 y 47 del Reglamento de la Ley N° 26454, Ley que declara de orden público e interés nacional la obtención, donación, conservación, transfusión y suministro de sangre humana, aprobado por Decreto Supremo N° 03-95-SA y su modificatoria, en los siguientes términos:
Artículo 13.- Los Bancos de Sangre son Servicios Médicos de Apoyo – SMA, debidamente autorizados por el Ministerio de Salud, e inscritos en el Registro Nacional de Centros de Hemoterapia, Bancos de Sangre y Plantas de Hemoderivados. Estos SMA, realizan directamente la promoción, captación, colecta, procesamiento y distribución de sangre y/o fracciones en forma oportuna, en calidad y cantidad necesarias para ser aplicadas con fines terapéuticos, según corresponda.
Artículo 14.- Los Bancos de Sangre se clasifican en:
14.1 Banco de Sangre tipo I: También denominado Centro de Hemoterapia, es un SMA dependiente de un Establecimiento de Salud, debidamente autorizado por el Ministerio de Salud, e inscrito en el Registro Nacional de Centros de Hemoterapia, Bancos de Sangre y Plantas de Hemoderivados. Cuenta con cartera de servicios que requieran hemocomponentes y aféresis terapéutica. Recepciona hemocomponentes tamizados con Sello Nacional de Calidad de Sangre de los Bancos de Sangre Tipo II y/o III, almacenamiento temporal, pruebas inmunohematológicas (pruebas de compatibilidad, grupo sanguíneo de las unidades de sangre y del receptor, anticuerpos irregulares, Coombs directo e indirecto, y otras pruebas de acuerdo al avance tecnológico), eliminación de hemocomponentes (caducidad, por contaminación bacteriana, rotura de bolsas, entre otras), distribución interna de hemocomponentes a los servicios hospitalarios, promoción de la donación voluntaria de sangre.
Los Bancos de Sangre tipo I se subclasifican a su vez en:
Tipo I A: Demanda de paquetes globulares hasta 100 unidades al año.
Tipo I B: Demanda de paquetes globulares desde 101 hasta 1000 unidades al año.
Tipo I C: Demanda de paquetes globulares desde 1001 unidades al año.
14.2 Banco de Sangre tipo II: Es un SMA que depende de un Establecimiento de Salud, debidamente autorizado por el Ministerio de Salud, e inscrito en el Registro Nacional de Centros de Hemoterapia, Bancos de Sangre y Plantas de Hemoderivados, que cuenta con cartera de servicios que requieran hemocomponentes y aféresis terapéutica. Produce hemocomponentes. Cuenta con una producción de paquetes globulares mayor de 2500 unidades de paquetes globulares al año o de acuerdo a la demanda poblacional, acceso geográfico y perfil epidemiológico cuando la Autoridad Nacional de Salud lo considere, se encarga de la promoción de la donación voluntaria de sangre, captación de los donantes voluntarios de sangre, selección del donante, colecta de sangre, fraccionamiento, cuarentena temporal de unidades de sangre y hemocomponentes sin tamizaje, pruebas inmunoserológicas (tamizaje), pruebas inmunohematológicas (pruebas de compatibilidad, grupo sanguíneo de las unidades de sangre y del receptor, anticuerpos irregulares, Coombs directo e indirecto, y otras pruebas de acuerdo al avance tecnológico), etiquetado con Sello Nacional de Calidad de Sangre, almacenamiento de unidades de sangre y hemocomponentes tamizadas, distribución de hemocomponentes a los Servicios Hospitalarios o a los Bancos de Sangre tipo I a través de convenios, eliminación de unidades de sangre y hemocomponentes.
14.3 Banco de Sangre tipo III: Denominado también Hemocentro. Es un SMA público extrahospitalario. Depende funcional y administrativamente de la DIRIS/DIRESA/GERESA, y cuenta con asignación presupuestal. Debidamente autorizado por el Ministerio de Salud, e inscrito en el Registro Nacional de Centros de Hemoterapia, Bancos de Sangre y Plantas de Hemoderivados. Estos Hemocentros deben producir un mínimo de 10,000 unidades de paquetes globulares al año cuando su capacidad operativa sea en condiciones normales y en su totalidad. Se encarga de la promoción de la donación voluntaria de sangre, captación de los donantes voluntarios de sangre, selección del donante, colecta de sangre, fraccionamiento, cuarentena temporal de unidades de sangre y hemocomponentes sin tamizaje, pruebas inmunoserológicas (tamizaje) incluye Test de Ácido Nucleicos (NAT) u otras pruebas de acuerdo al avance tecnológico, pruebas inmunohematológicas especiales (grupo sanguíneo ABO, Rh y otros sistemas de grupos sanguíneos a las unidades de sangre, anticuerpos irregulares, Coombs directo del donante de sangre, y otras pruebas de acuerdo al avance tecnológico), etiquetado con Sello Nacional de Calidad de Sangre, almacenamiento de unidades de sangre y hemocomponentes tamizados, distribución de hemocomponentes a los Bancos de Sangre tipo I y eliminación de unidades de sangre y hemocomponentes.
Artículo 45.- Definición de Autorización Sanitaria de Funcionamiento
Acto administrativo mediante el cual el Ministerio de Salud autoriza el funcionamiento de los Bancos de Sangre para iniciar sus actividades relacionadas a la provisión de hemocomponentes.
La Autorización Sanitaria de Funcionamiento tiene vigencia de cuatro (4) años, pudiendo ser renovada, de corresponder, por un período igual, a solicitud del administrado.
Artículo 46.- De la Autorización Sanitaria de Funcionamiento
La Autorización Sanitaria de Funcionamiento de Banco de Sangre es un procedimiento administrativo de evaluación previa, sujeto a silencio administrativo negativo, con un plazo máximo de duración de treinta (30) días hábiles contados desde el ingreso de la solicitud.
El Ministerio de Salud, a través de la Dirección General de Donaciones, Trasplantes y Banco de Sangre o la que haga sus veces, mediante Resolución Directoral otorga la Autorización Sanitaria de Funcionamiento a los Bancos de Sangre tipo I y a los Bancos de Sangre tipo II, previo informe técnico favorable de la Dirección de Banco de Sangre y Hemoterapia – PRONAHEBAS.
El Ministerio de Salud, mediante Resolución Ministerial, otorga Autorización Sanitaria de Funcionamiento a los Bancos de Sangre Tipo III, previo informe técnico favorable de la Dirección de Banco de Sangre y Hemoterapia – PRONAHEBAS, de la Dirección General de Donaciones, Trasplantes y Banco de Sangre o la que haga sus veces.
46.1.- Requisitos para obtener la Autorización Sanitaria de Funcionamiento
Los requisitos para obtener la Autorización Sanitaria de Funcionamiento de Banco de Sangre son:
a) Solicitud de Autorización Sanitaria de Funcionamiento de Banco de Sangre Tipo I, Tipo II o Tipo III, según corresponda, de acuerdo al Anexo 01 del presente reglamento.
b) Declaración Jurada de cumplimiento de las condiciones para el funcionamiento de los bancos de sangre Tipo I, Tipo II, Tipo III conforme al anexo 02 del presente Reglamento.
c) Copia del Plano arquitectónico del Banco de Sangre, donde se señale las áreas.
d) Relación de equipos señalando la denominación, marca, modelo y número de serie.
e) Copia del Currículo vitae de todo el personal.
46.2.- Procedimiento Administrativo para la Autorización Sanitaria de Funcionamiento de los Bancos de Sangre.
El procedimiento que se sigue para tramitar la Autorización Sanitaria de funcionamiento de Banco de Sangre es el siguiente:
a) Presentación por parte del administrado de la Solicitud de Autorización Sanitaria de Funcionamiento en mesa de parte física o virtual del Ministerio de Salud, adjuntando los requisitos establecidos en el numeral 46.1 del presente reglamento.
b) Visita de verificación de cumplimiento de las condiciones y requisitos establecidos en el presente Reglamento para la Autorización Sanitaria de Funcionamiento de los Bancos de Sangre.
c) Emisión del acto resolutivo.
46.2.1 De la solicitud de Autorización Sanitaria de Funcionamiento
a) Se presenta la solicitud de Autorización Sanitaria de Funcionamiento (Anexo 01), firmada por el representante de la Institución Prestadora de Servicios de Salud – IPRESS, en la mesa de partes, física o virtual, del Ministerio de Salud, adjuntando los requisitos establecidos en el numeral 46.1 del presente reglamento.
Los documentos deben estar debidamente foliados.
a.1 La Dirección de Banco de Sangre y Hemoterapia – PRONAHEBAS de la Dirección General de Donaciones, Trasplantes y Banco de Sangre del Ministerio de Salud, revisa la documentación presentada por el administrado, dentro de los cinco (5) días hábiles de recibida la solicitud.
– De estar conforme la documentación presentada, se comunica al administrado la fecha para la visita de verificación.
– De no estar conforme la documentación presentada, se notifica al administrado para que en un plazo de tres (3) días hábiles de recibida la notificación cumpla con subsanar las observaciones.
– Subsanada(s) la(s) observación(es), se notifica al administrado la fecha para la visita de verificación.
– De persistir la(s) observación(es) se procederá al cierre del expediente y archivo, lo que será notificado al administrado, quedando subsistente el derecho del administrado a impugnar o volver a solicitar la Autorización Sanitaria respectiva cuando lo considere pertinente.
46.2.2 De la visita de verificación
El objeto de la visita de verificación es constatar el cumplimiento de las condiciones y requisitos establecidos en el presente Reglamento para la Autorización Sanitaria de Funcionamiento de los Bancos de Sangre.
La Visita de Verificación es realizada de manera presencial, dentro de un plazo de doce (12) días hábiles contados desde la fecha de la conformidad de la solicitud de la autorización sanitaria presentada.
La Visita de Verificación de los Bancos de Sangre tipo I, es realizada por PRONAHEBAS pudiendo ser delegada a los Coordinadores de PRONAHEBAS en las Regiones y en Lima Metropolitana. Para los Bancos de Sangre tipo II y III, la Visita de Verificación estará a cargo exclusivamente del PRONAHEBAS.
Realizada la visita de verificación:
– De no existir observaciones en la visita de verificación, en un plazo de cinco (5) días hábiles, se procede a emitir el acto resolutivo que otorga la autorización sanitaria.
– De existir observaciones en la visita de verificación, se otorgará al administrado tres (3) días hábiles a fin de que cumpla con subsanar dichas observaciones, contados a partir de la suscripción del Acta de Visita de Verificación.
– Subsanada(s) la(s) observación(es), en un plazo de siete (7) días hábiles, se procede a emitir acto resolutivo que otorga la autorización sanitaria.
De persistir la(s) observación(es), se procederá al cierre del expediente y archivo lo que será notificado al administrado, quedando subsistente el derecho del administrado a impugnar a través de los recursos de reconsideración o apelación o volver a solicitar la Autorización Sanitaria respectiva cuando lo considere pertinente.
46.2.3. De la Emisión del acto resolutivo
El Ministerio de Salud, a través de la Dirección General de Donaciones, Trasplantes y Banco de Sangre o la que haga sus veces, mediante Resolución Ministerial o Resolución Directoral, según corresponda, otorga la Autorización Sanitaria de Funcionamiento a los Bancos de Sangre tipo I, II y III, previo informe técnico favorable de la Dirección de Banco de Sangre y Hemoterapia – PRONAHEBAS.
El acto administrativo que deniega la autorización sanitaria de funcionamiento podrá ser materia de impugnación a través de los recursos impugnativos de reconsideración y/o apelación, de conformidad a lo establecido en el Texto Único Ordenado de la Ley N° 27444, Ley del Procedimiento Administrativo General.
La Dirección General de Donaciones, Trasplantes y Banco de Sangre, o la que haga sus veces, es el órgano competente para resolver el recurso de reconsideración. El recurso de apelación es resuelto por el Despacho del Viceministerio de Salud Pública, o el que haga sus veces; con lo cual queda agotada la vía administrativa.
Si al vencimiento del plazo, el recurso impugnatorio no ha sido resuelto por la administración, procederá el silencio administrativo negativo, y con ello se genera el derecho del administrado para accionar judicialmente; lo que no significa que se obligue al referido administrado a solicitar tutela cautelar.
46.3 De las modificaciones de las IPRESS que cuentan con Bancos de Sangre
De existir modificaciones de parte de la IPRESS relacionadas a la infraestructura, recursos humanos, equipamiento o documentos de gestión, cambio de dirección domiciliaria, suspensión temporal y/o cierre de la IPRESS, y/o cualquier adición, modificación o eliminación de cualquier elemento que afecte directa o indirectamente el funcionamiento de los servicios del Banco de Sangre de la IPRESS, que se hayan dado con posterioridad a la obtención de Autorización Sanitaria de Funcionamiento correspondiente, ésta debe informar al PRONAHEBAS, para su evaluación, en un plazo no mayor de quince (15) días calendarios de ocurrido el hecho.
46.4 Del Convenio para el abastecimiento de hemocomponentes
Los Bancos de Sangre Tipo II o Tipo III deben suscribir convenios con los Bancos de Sangre tipo I para el abastecimiento de unidades de sangre y hemocomponentes. Asimismo, los Bancos de Sangre Tipo I debidamente autorizados remiten a la Dirección General de Donaciones, Trasplantes y Banco de Sangre o la que haga sus veces, el convenio para el abastecimiento de hemocomponentes, en un plazo de treinta (30) días calendarios contados desde la notificación de la Autorización Sanitaria de Funcionamiento.
46.5 De la medida de seguridad
a. Suspensión de la Autorización:
a.1 La suspensión de la Autorización Sanitaria de funcionamiento de los Bancos de Sangre es realizada por la Dirección General de Donaciones, Trasplantes y Banco de Sangre o la que haga sus veces, como medida preventiva que prohíbe el funcionamiento del Banco de Sangre ante la evidencia de un hecho que pone en riesgo la vida y la salud de los usuarios de los Bancos de Sangre. Esta medida de seguridad se mantendrá vigente hasta que la IPRESS levante la(s) observación(es) que motivaron la imposición de la medida de seguridad.
a.2 La suspensión puede ser:
· Suspensión temporal: Se suspende la Autorización Sanitaria de Funcionamiento por un periodo de diez (10) días hábiles, a fin de que el administrado subsane las observaciones realizadas por PRONAHEBAS dentro de este plazo. De subsanarse la observación, el PRONAHEBAS levanta la suspensión temporal, a través de un informe técnico, previa evaluación, en un plazo máximo de tres (3) días hábiles de recepcionada la documentación.
Las causas de suspensión temporal de la Autorización Sanitaria de Funcionamiento de los bancos de sangre son las siguientes:
Banco de Sangre tipo I:
a) Utilización de Hemocomponentes sin sello nacional de calidad de sangre del PRONAHEBAS.
b) No realiza pruebas cruzadas.
c) Uso de reactivos vencidos.
d) No cuenta con conservadora de sangre de 2°C a 6°C biomédica.
e) No cuenta con convenio vigente con el Banco de Sangre tipo II o tipo III.
Banco de Sangre tipo II:
a) Utilización de hemocomponentes sin tamizaje de la/las prueba/s exigidas por PRONAHEBAS, o con metodología no estandarizada ni aprobada por las instancias internacionales.
b) No cuenta con conservadora de 2°C a 6°C biomédica.
c) Resultados del Programa de Evaluación externa del desempeño en Inmunoserología (PEVED) – INS: Nivel C: falsos negativos, debidamente confirmados o de un Programa Internacional similar.
d) No realiza prueba cruzada.
e) No cuenta con sello nacional de calidad de sangre del PRONAHEBAS.
f) No realizan procedimiento de centrifugación para la separación de los hemocomponentes (No cuenta con centrifuga refrigerada).
g) No cuenta con separación de hemocomponentes semiautomatizada.
h) Uso de reactivos vencidos.
i) No realizan selección del donante.
Banco de Sangre tipo III:
a) Utilización de hemocomponentes sin tamizaje de la/las prueba/s exigidas por PRONAHEBAS, o con metodología no estandarizada ni aprobada por las instancias internacionales.
b) No cuenta con conservadora de 2°C a 6°C biomédica.
c) Resultados del Programa de Evaluación externa del desempeño en Inmunoserología (PEVED) – INS: Nivel C: falsos negativos, debidamente confirmados o de un Programa Internacional similar.
d) No cuenta con sello nacional de calidad de sangre del PRONAHEBAS.
e) No realizan procedimiento de centrifugación para la separación de los hemocomponentes (No cuenta con centrifuga refrigerada).
f) No cuenta con separación de hemocomponentes semiautomatizada.
g) Uso de reactivos vencidos.
h) No realizan selección del donante.
– Suspensión definitiva: De no subsanarse la observación en el plazo señalado para la suspensión temporal, la Dirección General de Donaciones, Trasplantes y Banco de Sangre o la que haga sus veces del Ministerio de Salud, procede a la suspensión definitiva de la Autorización Sanitaria de Funcionamiento y al cierre del Banco de Sangre comunicando a la DIRIS/DIRESA/GERESA y a la Superintendencia Nacional de Salud (SUSALUD), a fin de que dichas instancias tomen las medidas correspondientes en el ámbito de sus competencias.
Artículo 47.- De la Renovación de la Autorización Sanitaria de Funcionamiento
La Renovación de la Autorización Sanitaria de Funcionamiento de Banco de Sangre es un procedimiento administrativo de evaluación previa, sujeto a silencio administrativo negativo, con un plazo máximo de duración de treinta (30) días hábiles contados desde el ingreso de la solicitud.
La solicitud de Renovación de la Autorización Sanitaria se presenta en la mesa de partes, física o virtual, del Ministerio de Salud, treinta (30) días hábiles antes de la fecha de vencimiento de la Autorización Sanitaria, dirigida a la Dirección General de Donaciones, Trasplantes y Bancos de Sangre o la que haga sus veces.
47.1 Requisitos para obtener la Renovación de la Autorización Sanitaria de Funcionamiento
Los Bancos de Sangre que soliciten la renovación de su Autorización Sanitaria de Funcionamiento deben adjuntar los siguientes requisitos:
a) Solicitud de Renovación (Anexo 01).
b) Copia de Convenio(s) interinstitucional(es) vigente(s) entre Bancos de Sangre para el abastecimiento de sangre y hemocomponentes.
c) Declaración Jurada de cumplimiento de las condiciones para el funcionamiento de los bancos de sangre Tipo I, Tipo II, Tipo III conforme al anexo 02 del presente Reglamento.
47.2 Procedimiento para obtener la Renovación de la Autorización Sanitaria de Funcionamiento
a) La Dirección de Banco de Sangre y Hemoterapia (PRONAHEBAS), verifica que el Banco de Sangre solicitante cumpla con los requisitos señalados en el numeral 47.1 del artículo 47 del presente Reglamento.
b) El procedimiento para obtener la renovación de Autorización Sanitaria de funcionamiento de los Bancos de Sangre sigue el mismo procedimiento dispuesto en el numeral 46.2, del artículo 46 del presente Reglamento.
c) De no solicitar la renovación de la autorización sanitaria en el plazo señalado en el artículo 47 del presente Reglamento, el administrado podrá solicitar una nueva Autorización Sanitaria de Funcionamiento, cumpliendo lo dispuesto en el artículo 46.2 del artículo 46 del presente Reglamento.
d) Vencido el plazo para solicitar la renovación y habiendo concluido la vigencia de la Autorización Sanitaria de Funcionamiento, el Banco de Sangre no podrá continuar brindando sus servicios. La Dirección General de Donaciones, Trasplantes y Banco de Sangre pondrá de conocimiento el vencimiento de la Autorización Sanitaria de Funcionamiento del Banco de Sangre a las entidades competentes, para los fines pertinentes.
Artículo 3.- Incorporación de los Anexos 01, 02, 03, 04 y 05 en el Reglamento de la Ley Nº 26454, que declaró de orden público la obtención, donación, transfusión y suministro de sangre humana, aprobado con Decreto Supremo Nº 03-95-SA y su modificatoria.
Incorpórese los Anexos 01, 02, 03, 04 y 05 en el Reglamento de la Ley Nº 26454, que declaró de orden público la obtención, donación, transfusión y suministro de sangre humana, aprobado con Decreto Supremo Nº 03-95-SA y su modificatoria cuyos textos forman parte integrante del presente Decreto Supremo.
Artículo 4.- Publicación
Dispóngase la publicación del presente Decreto Supremo en el Portal del Estado Peruano (www.peru.gob.pe) y en el Portal Institucional del Ministerio de Salud (www.minsa.gob.pe), el mismo día de su publicación en el Diario Oficial El Peruano.
Artículo 5.-Refrendo
El presente Decreto Supremo es refrendado por el Ministro de Salud.
DISPOSICIONES COMPLEMENTARIAS FINALES
Primera.- La DIGDOT o la que haga sus veces impulsa el desarrollo de la cultura de Donación Voluntaria de Sangre, a fin de disminuir progresivamente la donación de sangre por reposición, para contribuir a mejorar la calidad, oportunidad y seguridad transfusional.
Segunda.- Los Bancos de Sangre que cuenten con Autorización Sanitaria de Funcionamiento, son inscritos en el Registro Nacional de Centros de Hemoterapia, Bancos de Sangre y Plantas de Hemoderivados o el que haga sus veces.
Tercera.- Los Bancos de Sangre Tipo I C con alta producción anual, previa autorización expresa del PRONAHEBAS, podrán realizar las acciones de selección de donante, extracción y fraccionamiento de sangre, pero no de tamizaje; además deben contar con Convenio vigente con un Banco de Sangre Tipo II que será quien realice el tamizaje. Estos bancos autorizados son supervisados por el PRONAHEBAS en el desarrollo de estas actividades.
DISPOSICIÓN COMPLEMENTARIA TRANSITORIA
Única.- Los Bancos de Sangre existentes al momento de la publicación del presente Decreto Supremo, en el contexto de la emergencia sanitaria por COVID-19, de manera excepcional, deben solicitar (Anexo 01) la Autorización Sanitaria de Funcionamiento, adjuntando los requisitos y las condiciones (Anexo 04) del presente Reglamento, en un plazo de seis (6) meses contados a partir del día siguiente de la publicación del presente Decreto Supremo. Transcurrido un (1) año de la obtención de la Autorización Sanitaria de Funcionamiento, los Bancos de Sangre deben sujetarse a lo establecido en el anexo 03 del presente Reglamento.
DISPOSICIÓN COMPLEMENTARIA MODIFICATORIA
Única.- Incorporación del artículo 6-A en el Reglamento de la Ley N° 26454 “Ley que declara de orden público e interés nacional la obtención, donación, conservación, transfusión y suministro de sangre humana”, aprobado con Decreto Supremo N° 03-95-SA.
Incorporase el artículo 6-A al Reglamento de la Ley N° 26454, Ley que declara de orden público e interés nacional la obtención, donación, conservación, transfusión y suministro de sangre humana, aprobado con Decreto Supremo N° 03-95-SA, el que queda redactado de la siguiente manera:
Artículo 6-A.- Todos los Bancos de Sangre tipo I, tipo II y tipo III del país están obligados a vincular sus sistemas de información al Sistema Informático Nacional de Sangre del PRONAHEBAS – HEMORED, cuyo procedimiento se aprobará mediante Resolución Ministerial en un plazo de 90 días contados a partir del día siguiente de su publicación.
Dado en la Casa de Gobierno, en Lima, a los nueve días del mes de setiembre del año dos mil veintidós.
JOSÉ PEDRO CASTILLO TERRONES
Presidente de la República
JORGE ANTONIO LÓPEZ PEÑA
Ministro de Salud

![TC: Restricción para contratar con el Estado por razón de parentesco no puede aplicarse de manera general a todas las entidades públicas; el impedimento solo aplica a la entidad donde el funcionario tiene influencia [Exp. 02545-2023-PA/TC]](https://img.lpderecho.pe/wp-content/uploads/2024/03/tribunal-constitucional-4-LPDerecho-218x150.jpg)


![Excepción a la regla de no exigencia en la precisión de la fecha en el delito de violación sexual: La precisión de las fechas no es determinante si se precisan circunstancias periféricas; sin embargo, cuando las contradicciones en la precisión de tiempo, lugar o circunstancias son reiterativas y variables en los diferentes elementos de prueba (declaración en Cámara Gesell, ante el médico legista, ante el psicólogo), generan incertidumbre que debe ser esclarecida, ya que provienen de la misma fuente incriminatoria [Apelación 395-2024, Cajamarca]](https://img.lpderecho.pe/wp-content/uploads/2025/10/MAZO-JUEZ-SENTENCIA-PENAL-LPDERECHO-218x150.jpg)
![Las resoluciones «definitivas» son aquellas que concluyen el proceso; en cambio, las «interlocutorias» se emiten mientras el proceso está en curso y no afectan directamente la decisión final del mismo [Queja NCPP 1429-2023, Cajamarca, f. j. 4.8]](https://img.lpderecho.pe/wp-content/uploads/2025/07/MAZO-TRIBUNAL-LPDERECHO-218x150.jpg)
![Tenencia ilegal de municiones. Las municiones halladas en la vivienda del imputado están dentro de su órbita potestativa, al encontrarse a su libre disposición entre sus pertenencias, de modo que no se trata de una tenencia esporádica [Queja NCPP 289-2023, La Libertad, f. j. 4.6]](https://img.lpderecho.pe/wp-content/uploads/2025/10/MAZO-BALANZA-LIBROS-LPDERECHO-218x150.jpg)

![Ley Orgánica del Registro Nacional de Identificación y Estado Civil (Ley 26497) [actualizada 2025]](https://img.lpderecho.pe/wp-content/uploads/2025/05/Ley-organica-del-registro-nacional-de-identificacion-y-estado-civil1-LPDERECHO-218x150.jpg)
















![[VIVO] Clase modelo sobre las 10 sentencias laborales más relevantes del 2025. Llena el formulario para recibir las diapositivas](https://img.lpderecho.pe/wp-content/uploads/2025/12/INTERMEDIACION-DANTE-BOTTON-GIRON-LPDERECHO1-218x150.jpg)




![Multan a Win por publicidad engañosa al afirmar que ofrece el internet «más rápido del mercado» con «la mejor conexión que nunca se cae» [Res. 233-2025/CCD-Indecopi]](https://img.lpderecho.pe/wp-content/uploads/2025/07/indecopi-exterior-10-anos-LPDerecho-218x150.jpg)

![Aprueban nuevos montos de la remuneración consolidada del personal militar y policial [Decreto Supremo 292-2025-EF]](https://img.lpderecho.pe/wp-content/uploads/2025/06/POLICIAS-MILITARES-LPDERECHO-218x150.jpg)

![Código Penal peruano [actualizado 2025]](https://img.lpderecho.pe/wp-content/uploads/2024/05/VENTA-CODIGO-PENAL-LPDERECHO-218x150.jpg)
![Código de Protección y Defensa del Consumidor (Ley 29571) [actualizado 2025] Codigo proteccion defensa consumidor - LPDercho](https://img.lpderecho.pe/wp-content/uploads/2024/05/Codigo-proteccion-defensa-consumidor-LPDercho-218x150.png)
![Decreto Legislativo del Notariado (Decreto Legislativo 1049) [actualizado 2025]](https://img.lpderecho.pe/wp-content/uploads/2025/10/DECRETO-LEGISLATIVO-NOTARIO-1049-2025-LPDERECHO-218x150.jpg)
![Ley General de Contrataciones Públicas [Ley 32069] (actualizada 2025)](https://img.lpderecho.pe/wp-content/uploads/2025/01/NUEVA-LEY-GENERAL-CONTRATACIONES-PUBLICAS-LPDERECHO-218x150.png)
![Ley Orgánica de Elecciones (Ley 26859) [actualizada 2025]](https://img.lpderecho.pe/wp-content/uploads/2025/05/Ley-organica-de-elecciones-LPDerecho-2025-218x150.jpg)






![[VÍDEO] ¿Quieres postular a la Fiscalía? Estas son las preguntas que hacen en las entrevistas](https://img.lpderecho.pe/wp-content/uploads/2021/10/postular-fiscalia-preguntas-entrevista-LP-218x150.jpg)











![Código Penal peruano [actualizado 2025]](https://img.lpderecho.pe/wp-content/uploads/2024/05/VENTA-CODIGO-PENAL-LPDERECHO-100x70.jpg)
![Multan a Win por publicidad engañosa al afirmar que ofrece el internet «más rápido del mercado» con «la mejor conexión que nunca se cae» [Res. 233-2025/CCD-Indecopi]](https://img.lpderecho.pe/wp-content/uploads/2025/07/indecopi-exterior-10-anos-LPDerecho-324x160.jpg)





![Multan a Win por publicidad engañosa al afirmar que ofrece el internet «más rápido del mercado» con «la mejor conexión que nunca se cae» [Res. 233-2025/CCD-Indecopi]](https://img.lpderecho.pe/wp-content/uploads/2025/07/indecopi-exterior-10-anos-LPDerecho-100x70.jpg)




![Sindicatos minoritarios pueden negociar colectivamente si presentan propuesta conjunta [Informe 000778-2025-Servir-GPGSC]](https://img.lpderecho.pe/wp-content/uploads/2024/04/trabajador-confianza-companero-companerismo-ambiente-laboral-sindicato-LPDerecho-324x160.jpg)