A través del Decreto Supremo 031-2023-SA, aprueban el Reglamento de regulación y fiscalización de sustancias peligrosas de uso doméstico e industrial.
Decreto Supremo que aprueba el Reglamento de Regulación y Fiscalización de Sustancias Peligrosas de Uso Doméstico, Industrial y/o en Salud Pública
DECRETO SUPREMO Nº 031-2023-SA
LA PRESIDENTA DE LA REPÚBLICA
CONSIDERANDO:
Que, los numerales I y II del Título Preliminar de la Ley N° 26842, Ley General de Salud, señalan que la salud es condición indispensable del desarrollo humano y medio fundamental para alcanzar el bienestar individual y colectivo; por lo que la protección de la salud es de interés público, siendo responsabilidad del Estado regularla, vigilarla y promoverla;
Que, el Capítulo VI del Título II de la precitada Ley regula las sustancias y productos peligrosos para la salud, disponiendo en sus artículos 96 y 97 que, en la importación, fabricación, almacenamiento, transporte, comercio, manejo y disposición de estas sustancias y productos, deben tomarse todas las medidas y precauciones necesarias para prevenir daños a la salud humana, animal o al ambiente, de acuerdo con la reglamentación correspondiente; y que, cuando la importación, fabricación, transporte, almacenamiento, comercio y empleo de una sustancia o producto se consideren peligrosos para la salud de la población, el Estado debe establecer las medidas de protección y prevención correspondientes;
Que, el artículo 98 de la citada Ley N° 26842, Ley General de Salud, refiere que la Autoridad de Salud competente dicta las normas relacionadas con la calificación de las sustancias y productos peligrosos, las condiciones y límites de toxicidad y peligrosidad de dichas sustancias y productos, los requisitos sobre información, empaque, envase, embalaje, transporte, rotulado y demás aspectos requeridos para controlar los riesgos y prevenir los daños que esas sustancias y productos puedan causar a la salud de las personas;
Que, el numeral 4) del artículo 3 del Decreto Legislativo N° 1161, Ley de Organización y Funciones del Ministerio de Salud, establece que el Ministerio de Salud es competente en salud ambiental e inocuidad alimentaria; y el artículo 4 del citado Decreto Legislativo dispone que el Sector Salud está conformado por el Ministerio de Salud, como organismo rector, las entidades adscritas a él y aquellas instituciones públicas y privadas de nivel nacional, regional y local, y personas naturales que realizan actividades vinculadas a las competencias establecidas en dicha Ley, y que tienen impacto directo o indirecto en la salud, individual o colectiva;
Que, los literales b) y h) del artículo 5 del acotado Decreto Legislativo, modificado por el Decreto Legislativo N° 1504, Decreto Legislativo que fortalece al Instituto Nacional de Salud para la prevención y control de las enfermedades, establecen que son funciones rectoras del Ministerio de Salud, formular, planear, dirigir, coordinar, ejecutar, supervisar y evaluar la política nacional y sectorial de promoción de la salud, vigilancia, prevención y control de las enfermedades, recuperación, rehabilitación en salud, tecnologías en salud y buenas prácticas en salud, bajo su competencia, aplicable a todos los niveles de gobierno; así como dictar normas y lineamientos técnicos para la adecuada ejecución y supervisión de la política nacional y políticas sectoriales de salud;
Que, conforme al artículo 1 del Decreto Ley N° 25909, concordante con el artículo 4 del Decreto Ley N° 25629, ninguna entidad, con excepción del Ministerio de Economía y Finanzas, puede irrogarse la facultad de dictar medidas destinadas a restringir o impedir el libre flujo de mercancías mediante la imposición de trámites, requisitos o medidas de cualquier naturaleza que afecten las importaciones o exportaciones y que, por ende, son nulos todos los actos que contravengan esta disposición, debiendo aprobarse dichas disposiciones únicamente mediante Decreto Supremo refrendado por el Ministerio de Economía y Finanzas y por el Sector involucrado;
Que, conforme la Ley N° 27790, Ley de Organización y Funciones del Ministerio de Comercio Exterior y Turismo, y su Reglamento de Organización y Funciones, aprobado mediante Decreto Supremo N° 005-2002-MINCETUR, el Ministerio de Comercio Exterior y Turismo define, dirige, ejecuta, coordina y supervisa la política de comercio exterior; se encarga de negociar, suscribir y poner en ejecución los acuerdos o convenios internacionales en materia de comercio exterior, integración, cooperación económica y social; así como velar por el cumplimiento de dichos acuerdos tanto en el ámbito nacional como en el internacional;
Que, resulta necesario reglamentar el Capítulo VI, De las Sustancias y Productos Peligrosos para la Salud, del Título II de la Ley N° 26842, Ley General de Salud, a fin de prevenir daños que pudieran causar estos productos por su inadecuada selección, manejo y uso;
De conformidad con lo establecido en el numeral 8 del artículo 118 de la Constitución Política del Perú; el Decreto Ley N° 25629, que restablece la vigencia del artículo 19 del Decreto Legislativo N° 701 y del artículo 44 del Decreto Legislativo N° 716, derogados por el artículo 2 de la Ley N° 25399; el Decreto Ley N° 25909, que dispone que ninguna entidad, con excepción del Ministerio de Economía y Finanzas, puede irrogarse la facultad de dictar medidas destinadas a restringir el libre flujo de mercancías tanto en las importaciones como en las exportaciones; la Ley N° 26842, Ley General de Salud; el Decreto Legislativo N° 1161, Ley de Organización y Funciones del Ministerio de Salud; y, la Ley N° 29158, Ley Orgánica del Poder Ejecutivo;
DECRETA:
Artículo 1.- Aprobar el Reglamento
Aprobar el Reglamento de regulación y fiscalización de sustancias peligrosas de uso doméstico, industrial y/o en salud pública, que consta de cuatro (4) Títulos, dieciocho (18) Capítulos, cuarenta y nueve (49) artículos, una (01) Disposición Complementaria Transitoria y un (01) Anexo, que forma parte integrante del presente Decreto Supremo.
Artículo 2.- Publicar
El presente Decreto Supremo y el Reglamento aprobado en el artículo 1, se publican en la Plataforma Digital Única del Estado Peruano para Orientación al Ciudadano (www.peru.gob.pe), así como en la sede digital del Ministerio de Salud (www.gob.pe/minsa), del Ministerio de Economía y Finanzas (www.gob.pe/mef) y, del Ministerio de Comercio Exterior y Turismo (www.gob.pe/mincetur), el mismo día de su publicación en el Diario Oficial El Peruano.
Artículo 3.- Refrendo
El presente Decreto Supremo es refrendado por el Ministro de Salud, por el Ministro de Economía y Finanzas, y por el Ministro de Comercio Exterior y Turismo.
DISPOSICIÓN COMPLEMENTARIA FINAL
Única.- Vigencia
El presente Decreto Supremo entra en vigencia en un plazo de seis (6) meses, contados a partir del día siguiente de su publicación en el Diario Oficial El Peruano.
Dado en la Casa de Gobierno, en Lima, al primer día del mes de diciembre del año dos mil veintitrés.
DINA ERCILIA BOLUARTE ZEGARRA
Presidenta de la República
JUAN CARLOS MATHEWS SALAZAR
Ministro de Comercio Exterior y Turismo
ALEX ALONSO CONTRERAS MIRANDA
Ministro de Economía y Finanzas
CÉSAR HENRY VÁSQUEZ SÁNCHEZ
Ministro de Salud
REGLAMENTO DE REGULACIÓN Y FISCALIZACIÓN DE SUSTANCIAS PELIGROSAS DE USO DOMÉSTICO, INDUSTRIAL Y/O EN SALUD PÚBLICA
TÍTULO I
DISPOSICIONES GENERALES
CAPÍTULO I
OBJETO, FINALIDAD, ÁMBITO DE APLICACIÓN Y DEFINICIONES
Artículo 1.- Objeto
El objeto del presente Reglamento es regular y fiscalizar sanitariamente las sustancias peligrosas de uso doméstico, industrial y/o en salud pública establecidas en el Capítulo VI del Título II de la Ley N° 26842, Ley General de Salud.
Artículo 2.- Finalidad
La finalidad del presente Reglamento es salvaguardar la salud de las personas y proteger el ambiente, garantizando que las sustancias peligrosas de uso doméstico, industrial y/o en salud pública, sean de calidad y minimizar los riesgos a la salud de la población y al ambiente; mediante su regulación y fiscalización.
Artículo 3.- Ámbito de aplicación
3.1. El presente Reglamento es de aplicación a las personas naturales y jurídicas que realizan actividades relacionadas con la importación, fabricación, formulación, elaboración, maquila, distribución, comercialización, almacenamiento, uso, manejo y destrucción de sustancias peligrosas de uso doméstico, industrial y/o en salud pública; de acuerdo a su clasificación en el presente Reglamento.
3.2. No es de aplicación para:
a) Los productos farmacéuticos, incluidos los estupefacientes, medicamentos de uso humano y las sustancias psicotrópicas.
b) Los aditivos para los alimentos.
c) Los hidrocarburos y sus derivados.
d) Los productos de desinfección de dispositivos médicos.
e) Los productos de uso agrícola y veterinario.
f) Insumos químicos y productos fiscalizados.
g) Las sustancias químicas radioactivas.
h) Las sustancias químicas controladas en la Ley Nº 29239, Ley sobre medidas de control de sustancias químicas susceptibles de empleo para la fabricación de armas químicas; y su Reglamento aprobado mediante Decreto Supremo N° 008-2011-PRODUCE o norma que lo sustituya.
i) El alcohol metílico y etílico regulados por la Ley Nº 27645, Ley que regula la comercialización de alcohol metílico, la Ley Nº 28317, Ley de control y fiscalización de la comercialización del alcohol metílico; y la Ley Nº 29632, Ley para erradicar la elaboración y comercialización de bebidas alcohólicas informales, adulteradas o no aptas para el consumo humano.
Artículo 4.- Definiciones
Para efectos del presente Reglamento, se utilizan las siguientes definiciones:
1) Acondicionamiento: Conjunto de operaciones a las que se debe someter un producto que se encuentra en su envase primario o secundario para convertirse en un producto formulado a ser distribuido o comercializado.
2) Almacenamiento: Conjunto de actividades que se realizan con el fin de asegurar que los productos formulados sean conservados en condiciones óptimas, desde que son elaborados hasta su comercialización, preservando su calidad y seguridad.
3) Advertencia: Llamado de atención, generalmente incluido en los textos de las etiquetas y/o empaques, sobre algún riesgo particular asociado al uso de los productos.
4) Agotamiento de stock: Es la situación de no disponibilidad de los productos, etiquetas, empaques, envases, rótulos o prospectos, que se encuentren en las instalaciones del establecimiento del fabricante o importador, según corresponda, lugares de almacenamiento u otras instalaciones previo a su comercialización; siempre que no tenga observaciones respecto a su calidad o seguridad.
5) Autoridad Sanitaria competente de nivel nacional: Es la Autoridad de Salud responsable de otorgar las autorizaciones sanitarias de sustancias peligrosas de uso doméstico, industrial y/o en salud pública, así como de velar por la implementación y cumplimiento del presente Reglamento.
6) Autorización sanitaria: Es el título habilitante otorgado por la Autoridad Sanitaria competente de nivel nacional que faculta a su titular la fabricación, importación o comercialización de las sustancias peligrosas de uso doméstico, industrial y/o en salud pública, previa evaluación de los documentos presentados.
7) Calidad: Es el conjunto de propiedades de un producto que determina su identidad, concentración, pureza y seguridad de su uso.
8) Certificado de libre comercialización: Documento oficial expedido por la Autoridad Nacional Competente o por la Autoridad Competente del país de origen, que indica que el producto está registrado y que su venta está autorizada legalmente en ese territorio.
9) Comercialización: Actividad que comprende las operaciones de compra, venta y distribución en el mercado nacional de productos formulados.
10) Composición básica: Es aquella que le confiere las propiedades principales al producto formulado.
11) Convenio de Estocolmo sobre Contaminantes Orgánicos Persistentes: Es un tratado internacional que entró en vigor el 17 de mayo de 2004, teniendo como objetivo la protección de la salud humana y el medio ambiente frente a los contaminantes orgánicos persistentes.
12) Convenio de Minamata sobre el Mercurio: Es un tratado internacional que entró en vigor el 16 de agosto de 2017, teniendo como objetivo proteger la salud humana y el medio ambiente de las emisiones y liberaciones antropógenas de mercurio y compuestos de mercurio.
13) Convenio de Rotterdam para la aplicación del Procedimiento de Consentimiento Fundamentado Previo a Ciertos Plaguicidas y Productos Químicos Peligrosos Objeto de Comercio Internacional: Es un tratado internacional que entró en vigor el 24 de febrero del 2004 y tiene por objetivo promover la responsabilidad compartida y los esfuerzos conjuntos de las Partes en la esfera del comercio internacional de ciertos productos químicos peligrosos a fin de proteger la salud humana y el medio ambiente frente a posibles daños. El convenio establece un procedimiento de consentimiento previo informado (CPI) para la importación de productos químicos peligrosos.
14) Desinfectante: Es un agente químico que destruye o inhibe el crecimiento de microorganismos patógenos en fase vegetativa o no esporulada. Los desinfectantes no necesariamente matan todos los organismos, pero los reducen a un nivel que no dañan la salud. Su aplicación es en superficies inertes, las cuales no incluyen dispositivos ni equipos médicos, así como las superficies quirúrgicas o áreas críticas.
15) Desinfectante de uso doméstico: Son aquellos autorizados expresamente para ser usados en el hogar, los cuales deben ser de bajo riesgo y no representar problema para la salud, de acuerdo a sus estudios de toxicidad aguda correspondiéndole las categorías de peligro de toxicidad aguda 4 o 5 según versión adoptada a nivel nacional del Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos.
Los productos desinfectantes de uso exclusivo del ámbito doméstico no se encuentran comprendidos bajo los alcances del presente Reglamento, siendo aplicable lo establecido en la Decisión 706.
16) Desinfectante de uso industrial: Son aquellos autorizados expresamente para ser usados en los establecimientos industriales, comerciales, educacionales, centros de esparcimiento, o recreacionales, almacenes, u otros locales similares en ambientes interiores y exteriores. Estos establecimientos no deben estar destinados a vivienda. Los desinfectantes de uso industrial deben ser manipulados por personal capacitado y haciendo uso del equipo de protección personal adecuado.
17) Desinfectantes de uso en salud pública: Son aquellos autorizados para ser usados en establecimientos de salud y servicios médicos de apoyo, y deben ser manipulados por personal capacitado haciendo uso del equipo de protección personal adecuado.
18) Desinfectantes para el agua de piscina: Son aquellos productos autorizados para ser usados en la desinfección del agua de las piscinas.
19) Distribución: Conjunto de actividades que se realiza desde el lugar de fabricación, almacenamiento y/o comercialización para poner el producto formulado a disposición de los consumidores.
20) Eficacia: Capacidad que tiene un producto para producir el efecto deseado, cumpliendo con los parámetros requeridos de calidad y de riesgo aceptable para la salud humana y el ambiente.
21) Embalaje: Cualquier cubierta o estructura destinada a agrupar, contener y proteger a una o más unidades de producto envasado y su contenido, tanto de los agentes exteriores como de los daños físicos, durante su almacenamiento y transporte, facilitando además el manejo durante dichas operaciones.
22) Envasado: Todas las operaciones, incluyendo las de llenado y etiquetado, a las que tiene que ser sometido un producto para que se convierta en un producto formulado.
23) Envase primario: Todo recipiente que contiene y está en contacto directo con la sustancia peligrosa y similar de uso doméstico, industrial y/o en salud pública.
24) Envase secundario o empaque: Caja, estuche, termo-encogido o cualquier otro sistema que contiene el envase primario, cuya función es la protección del mismo, hasta su entrega al consumidor.
25) Estudio de eficacia: Prueba desarrollada bajo el método científico experimental para comprobar las instrucciones de uso de un plaguicida con la finalidad de obtener la autorización sanitaria. Los estudios de eficacia deben ser realizados y emitidos por personas naturales o jurídicas, públicas o privadas, para lo cual debe usar preferentemente la lista referencial determinada por la Autoridad Sanitaria competente de nivel nacional.
26) Etiqueta o rotulado: Cualquier expresión, marca, imagen u otro material descriptivo o gráfico que se haya escrito, impreso, estarcido, marcado, marcado en relieve, adherido al envase primario o secundario del producto formulado. El etiquetado contiene la información detallada en el artículo 11 del presente reglamento.
27) Elaboración: Operaciones involucradas en la preparación de una sustancia peligrosa o similar de uso doméstico industrial y/o en salud pública, desde la recepción de los materiales, pasando por el proceso, el envasado y el acondicionamiento, hasta obtener el producto formulado.
28) Fabricación: Conjunto de actividades y operaciones (mecánicas, físicas o químicas) con el fin de obtener un producto formulado que puede contener uno o más ingredientes activos uniformemente distribuidos en uno o más aditivos, con o sin ayuda de acondicionadores de fórmula.
29) Fiscalización posterior: Procedimiento por el cual la entidad verifica de oficio y mediante el sistema del muestreo la autenticidad de las declaraciones, documentos, informaciones y traducciones proporcionadas por los administrados en los procedimientos regulados por este Reglamento, dando lugar, de ser el caso, a responsabilidad administrativa y/o penal, conforme a la Ley de la materia.
30) Formulación: Actividad en la que una variedad de sustancias diferentes (ingredientes activos, aditivos, acondicionadores) se combinan en proporciones precisas para crear un producto formulado.
31) Ficha de Datos de Seguridad: Es el documento que consta de dieciséis (16) epígrafes y que proporciona información de acuerdo al Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos (SGA) de la Organización de las Naciones Unidas, a fin que se realice un adecuado uso para reducir los riesgos laborales, en salud y ambientales; incluye información sobre sus peligros, medidas de seguridad, entre otras consideraciones para su gestión. Es un documento equivalente a la Hoja de datos de seguridad, y en concordancia con el producto, según el Decreto Legislativo N° 1570, Decreto Legislativo que aprueba la Ley de Gestión Integral de Sustancias Químicas.
32) Importación: Es la actividad por la cual se adquiere un producto formulado proveniente del exterior, para ser destinado al consumo en el territorio nacional.
33) Ingrediente activo: Es aquella sustancia del producto formulado responsable del efecto deseado. Un producto formulado puede tener uno o más ingredientes activos.
34) Maquila: Servicio que brinda un tercero (persona natural o jurídica) a otra empresa para la elaboración de un producto formulado, previo acuerdo comercial entre las partes.
35) Plaga: Cualquier biotipo o microorganismo animal dañino para personas, animales u objetos inanimados.
36) Plaguicida: Cualquier sustancia o mezcla de sustancias con ingredientes químicos o biológicos destinados a repeler, destruir o controlar determinada plaga.
37) Plaguicidas de uso doméstico: Son aquellos destinados a combatir plagas en superficies inertes del interior y exterior de viviendas, los cuales deben estar listos para usar. Su toxicidad debe estar dentro de la categoría 4 o 5 según versión adoptada a nivel nacional del Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos.
38) Plaguicidas de uso en salud pública: Son aquellos destinados al control de vectores de enfermedades transmisibles al ser humano; destinados a operaciones de desinsectación y desratización en lugares públicos y privados, establecimientos de salud y servicios médicos de apoyo, para fines de saneamiento ambiental y salud humana. Los plaguicidas en salud pública deben ser aplicados por personal especialmente capacitado y entrenado para tal fin, usando los equipos de protección personal, de acuerdo a las especificaciones del fabricante.
39) Plaguicidas de uso industrial: Son aquellos autorizados expresamente a ser usados en las superficies de los establecimientos industriales, comerciales, educacionales, centros de esparcimiento, o recreacionales, almacenes, u otros locales similares en ambientes interiores y exteriores. Estos establecimientos no deben estar destinados a vivienda. Los plaguicidas de uso industrial deben ser aplicados por personal de empresas de saneamiento (debidamente autorizadas) y especialmente capacitado para tal fin, usando los equipos de protección personal, de acuerdo a las especificaciones del fabricante.
40) Plan de manejo del producto: Documento donde se detallan las condiciones de transporte, almacenamiento, manipulación del producto, las medidas contra incendios y la disposición final del producto en concordancia con lo establecido en el Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos, desde su internamiento en el país hasta su comercialización o uso y la disposición final de los residuos en caso se generen. En el Anexo del presente Reglamento se detalla la estructura del referido plan.
41) Producto formulado: Producto final útil y eficiente según su propósito, destinado al consumidor final.
42) Productos no destinados al comercio: Productos formulados importados con la finalidad de ser utilizados en estudios de investigación, estudios de mercadeo o uso propio del solicitante del procedimiento administrativo. Tales productos no son destinados al comercio.
43) Producto químico de uso industrial: Es aquel producto formulado cuya finalidad es la limpieza y mantenimiento de superficies inertes en instalaciones industriales y/o profesionales, los cuales deben ser manipulados por personal capacitado y haciendo uso del equipo de protección personal adecuado.
44) Producto peligroso: Es aquel producto químico prohibido o rigurosamente restringido (en el país de procedencia) incluido en el Anexo III del Convenio de Rotterdam para la aplicación del Procedimiento de Consentimiento Fundamentado Previo a Ciertos Plaguicidas y Productos Químicos Peligrosos Objeto de Comercio Internacional (en adelante, Convenio de Rotterdam), para lo cual debe contar con el Consentimiento Fundamentado Previo (PIC) emitido por la autoridad competente.
45) Profesional competente: Es el/la responsable de los aspectos técnicos relacionados al producto. El/la profesional tiene los conocimientos fundamentales en el Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos; así como de las propiedades físico-químicas y toxicológicas, adecuados al uso, manejo, transporte, almacenamiento y seguridad a que están destinadas las sustancias peligrosas y similares de uso doméstico, industrial y/o en salud pública para su correcta aplicación por parte del usuario y del operario que las manipule. Debe ser de profesión biólogo, ingeniero industrial, ingeniero químico, químico o químico farmacéutico o profesiones afines.
46) Riesgo: Probabilidad ante la exposición que tiene un producto de causar o desarrollar efectos adversos a la salud humana o al ambiente.
47) Sistema Globalmente Armonizado de Clasificación y Etiquetado de productos químicos (SGA o GHS por sus siglas en inglés): Es un sistema acordado internacionalmente que, establece criterios armonizados para clasificar sustancias y mezclas con respecto a sus peligros físicos, para la salud y para el medio ambiente. Incluye además elementos armonizados para la comunicación de peligros, con requisitos sobre etiquetas, pictogramas y fichas de seguridad. Los criterios establecidos en el SGA se basan en lo descrito en un documento denominado Libro Púrpura.
48) Sustancia peligrosa de uso doméstico, industrial y/o en salud pública: Es aquel producto formulado de naturaleza sólida, líquida, gaseosa, pastosa o plasma que pueden presentar algún peligro físico, para la salud o para el ambiente. Esta definición abarca a los productos clasificados en el presente Reglamento.
49) Toxicidad: Propiedad que determina la capacidad de una sustancia química para causar perjuicio o producir daños a un organismo vivo por medios no mecánicos.
CAPÍTULO II
AUTORIDAD DE SALUD COMPETENTE
Artículo 5.- Autoridad Sanitaria competente de nivel nacional
5.1 El Ministerio de Salud, a través de la Dirección General de Salud Ambiental e Inocuidad Alimentaria – DIGESA, constituye la autoridad competente a nivel nacional para implementar y ejecutar el presente Reglamento.
5.2 La facultad sancionadora en materia de infracciones y sanciones corresponde exclusivamente a la Autoridad Sanitaria competente de nivel nacional a través de la DIGESA.
Artículo 6.- Funciones de la Autoridad Sanitaria competente
Son funciones de la Autoridad Sanitaria competente de nivel nacional las siguientes:
a) Controlar el uso y comercialización de sustancias peligrosas de uso doméstico, industrial y/o en salud pública, verificando que el producto no represente riesgos a salud ambiental;
b) Emitir las normas técnicas y administrativas que correspondan al proceso de autorización de sustancias peligrosas de uso doméstico, industrial y/o en salud pública de acuerdo a lo establecido en el presente Reglamento;
c) Autorizar la importación, fabricación y comercialización de sustancias peligrosas de uso doméstico, industrial y/o en salud pública;
d) Fiscalizar, en materia de sustancias de uso doméstico, industrial y/o en salud pública a instituciones públicas y privadas, y personas naturales que realizan actividades que tienen impacto directo o indirecto en la salud; así como establecer medidas de seguridad que la Ley y el Reglamento establezcan en resguardo de la salud pública;
e) Realizar el intercambio de información internacional que se deriva del Principio de Información y Consentimiento Previo – PIC, en el marco del Convenio de Rotterdam con la finalidad de emitir los Consentimientos Fundamentados Previos, en colaboración con el Ministerio del Ambiente y el Ministerio de Desarrollo Agrario y Riego, respecto de las sustancias peligrosas de uso doméstico, industrial y/o en salud pública.
TÍTULO II
AUTORIZACIÓN SANITARIA
CAPÍTULO I
CONDICIONES DE LOS PRODUCTOS
Artículo 7.- Condiciones de los productos
Las condiciones bajo las cuales se otorgó la autorización sanitaria deben mantenerse durante la fabricación, importación, almacenamiento, distribución y comercialización de las sustancias peligrosas de uso doméstico, industrial y/o en salud pública. La autorización sanitaria se otorga por producto formulado.
Artículo 8.- Nombre del producto
El nombre del producto formulado en cuya fabricación se utilizaron sustancias peligrosas de uso doméstico, industrial y/o en salud pública debe reflejar su identidad, declararse en la cara de visualización principal del envase, no debe inducir a error en cuanto a la composición, indicaciones o propiedades que posee el producto, ni propiciar su uso inadecuado.
Artículo 9.- Clasificación de los productos en cuya fabricación se utilizan sustancias peligrosas de uso doméstico, industrial y/o en salud pública
Los productos formulados en cuya fabricación se utilizan sustancias peligrosas de uso doméstico, industrial y/o en salud pública, para los fines del presente Reglamento se clasifican de la siguiente manera:
a) Productos químicos de uso industrial.
b) Productos desinfectantes de superficies inertes de uso doméstico, industrial y/o en salud pública; y, productos desinfectantes para agua de piscina.
c) Productos plaguicidas de uso doméstico, industrial y/o en salud pública.
d) Productos peligrosos en el marco del Convenio de Rotterdam.
CAPÍTULO II
ENVASES, EMBALAJES Y ETIQUETADO
Artículo 10.- Embalaje de los productos autorizados
El embalaje de los productos formulados autorizados debe contener la información acorde a lo establecido en la versión del Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos (SGA o GHS por sus siglas en inglés) adoptada a nivel nacional.
Artículo 11.- Etiquetado
11.1. La información contenida en el etiquetado del envase primario o secundario de los productos autorizados debe estar en castellano, ser legible y acorde a lo establecido en la versión del Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos (SGA o GHS por sus siglas en inglés) adoptada a nivel nacional. Asimismo, concordante con los datos declarados en la Ficha de Datos de Seguridad, composición, ensayos toxicológicos, estudios de eficacia en el combate de plagas, y estudios de enfrentamiento microbiano, cuando corresponda.
11.2. El etiquetado, debe contener, como mínimo, la siguiente información:
a) Nombre del producto,
b) Tipo de formulación.
c) Composición básica cuali-cuantitativa porcentual; resaltando al ingrediente activo (en caso corresponda).
d) Número de autorización sanitaria.
e) Nombre o razón social del fabricante.
f) País de fabricación.
g) Nombre o razón social del titular de la autorización, dirección fiscal y número de R.U.C.
h) Contenido neto del envase.
i) El número de lote o sistema de codificación de producción.
j) Fecha de vencimiento o caducidad del producto.
k) Condiciones de almacenamiento.
l) El ámbito de uso (doméstico, industrial, salud pública), según corresponda.
m) Modo de preparación, dosificación y métodos de aplicación.
n) Uso, precauciones y advertencias, incluyendo el teléfono en caso de emergencias.
o) Pictogramas o símbolos e indicaciones o frases de peligro, según corresponda de acuerdo a la naturaleza del producto formulado.
p) Consejos de prudencia, palabras de advertencia, clase y categoría de peligro, según corresponda.
11.3. Para los productos plaguicidas, además de la información consignada en el numeral anterior, el etiquetado debe contener:
a) Nombre de las plagas para el cual es eficaz el producto.
b) Tiempo de acción o eficacia acorde los respectivos estudios de eficacia.
11.4. Para los productos desinfectantes, además de la información consignada en los numerales anteriores, el etiquetado debe contener:
a) Nombre de los microorganismos para el cual es eficaz el producto.
b) Tiempo de acción o eficacia acorde a los respectivos ensayos de enfrentamiento microbiano.
11.5 La clasificación de peligros a ser considerada en la etiqueta deberá estar acorde a lo establecido en la versión del Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos adoptada a nivel nacional.
11.6 La Autoridad Sanitaria competente de nivel nacional podrá requerir que se mencionen en la etiqueta los componentes de la mezcla que contribuyan al peligro conforme lo establecido en el Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos.
11.7 Las sustancias peligrosas de uso doméstico, industrial y/o en salud pública importados podrán emplear stickers, los cuales deben estar firmemente adheridas de manera indeleble al envase primario o secundario.
CAPÍTULO III
AUTORIZACIÓN SANITARIA PARA PRODUCTOS QUÍMICOS DE USO INDUSTRIAL
Artículo 12.- Autorización sanitaria para productos químicos de uso industrial
La autorización sanitaria para productos químicos de uso industrial es el procedimiento administrativo que habilita la fabricación, importación, distribución, comercialización y almacenamiento de productos químicos de uso industrial, evaluando su formulación.
Artículo 13.- Requisitos para la autorización sanitaria para productos químicos de uso industrial
13.1 Para el presente procedimiento administrativo se exigen los siguientes requisitos:
a. Solicitud con carácter de Declaración Jurada, la cual debe contener – como mínimo – la siguiente información:
1. Tratándose de personas jurídicas: Su número de R.U.C. Además, nombre y apellido, teléfono y número de D.N.I. o Carné de Extranjería de su representante legal señalando que su poder se encuentra vigente, consignando el número de Partida Electrónica y asiento de inscripción en la Superintendencia Nacional de los Registros Públicos (SUNARP).
2. Tratándose de personas naturales: Nombre y apellido, número de D.N.I. o Carné de Extranjería.
3. En caso actúe en representación del titular del proyecto, consignar el nombre y apellido y número de D.N.I. o Carné de Extranjería del representante.
4. Domicilio legal del solicitante.
5. Fecha de pago y el número de comprobante del pago por derecho de tramitación.
6. Correo electrónico del solicitante o su representante, en caso autorice se le notifiquen comunicaciones o actos por dicho medio.
7. Nombre comercial y dirección del establecimiento.
b. De corresponder, adjuntar carta poder simple firmada por el poderdante indicando de manera obligatoria sus nombres, apellidos y número de documento de identidad, salvo que se trate de apoderados con poder inscrito en SUNARP, en cuyo caso basta una Declaración Jurada en los mismos términos establecidos para personas jurídicas.
c. Documento suscrito por profesional competente, conteniendo – como mínimo – la siguiente información:
1. Nombre y dirección del fabricante.
2. Forma de presentación.
3. Tipo y material de envase (cajas, frascos, cartón).
4. Dosis de aplicación.
5. Instrucciones de uso y manejo del producto.
6. Advertencias y precauciones.
d. Declaración Jurada emitida por el fabricante detallando los componentes del producto cuali-cuantitativamente al 100%.
e. Copia de la Ficha de Datos de Seguridad del producto, emitida por el fabricante y suscrita por el profesional competente.
f. Copia del documento que contenga el proyecto de etiqueta.
g. Copia del Certificado de libre comercialización o Certificado de registro vigente del producto a autorizar emitido por la Autoridad Competente del país de procedencia; excepcionalmente, en caso el país de origen no emita Certificado de libre comercialización o Certificado de registro del producto, se acepta un documento emitido por la entidad competente del país de origen que certifique los datos del fabricante del producto (en caso de que el producto sea de procedencia extranjera).
13.2. En todos los casos se debe presentar traducción simple, si el documento no se encuentra en castellano.
13.3. El procedimiento administrativo es un procedimiento de evaluación previa con aplicación del silencio administrativo negativo, cuyo pronunciamiento se emite en un plazo no mayor de treinta días hábiles.
13.4 La autorización sanitaria para productos químicos de uso industrial tiene una vigencia de tres años.
CAPÍTULO IV
RENOVACIÓN DE LA AUTORIZACIÓN SANITARIA PARA PRODUCTOS QUÍMICOS DE USO INDUSTRIAL
Artículo 14.- Renovación de la autorización sanitaria para productos químicos de uso industrial
14.1 La renovación de la autorización sanitaria para productos químicos de uso industrial es el procedimiento administrativo que habilita al titular de una autorización sanitaria, ya emitida, a continuar con las actividades de fabricación, importación, distribución, comercialización y almacenamiento de productos químicos de uso industrial, siempre y cuando mantenga las características de seguridad, calidad y eficacia con las que fue otorgada inicialmente.
14.2 La solicitud de renovación puede ser presentada por el titular de la autorización sanitaria hasta sesenta días hábiles anteriores a la fecha de su vencimiento.
Artículo 15.- Requisitos para la Renovación de la autorización sanitaria para productos químicos de uso industrial
15.1 Para el presente procedimiento administrativo se exigen los siguientes requisitos:
a. Solicitud con carácter de Declaración Jurada, la cual debe contener – como mínimo – la siguiente información:
1. Tratándose de personas jurídicas: Su número de R.U.C. Además, nombre y apellido, teléfono y número de D.N.I. o Carné de Extranjería de su representante legal señalando que su poder se encuentra vigente, consignando el número de Partida Electrónica y asiento de inscripción en la Superintendencia Nacional de los Registros Públicos (SUNARP).
2. Tratándose de personas naturales: Nombre y apellido, número de D.N.I. o Carné de Extranjería.
3. En caso actúe en representación del titular del proyecto, consignar el nombre y apellido y número de D.N.I. o Carné de Extranjería del representante.
4. Domicilio legal del solicitante.
5. Fecha de pago y el número de comprobante del pago por derecho de tramitación.
6. Correo electrónico del solicitante o su representante, en caso autorice se le notifiquen comunicaciones o actos por dicho medio.
7. Nombre comercial y dirección del establecimiento.
8. Número de Resolución Directoral que otorgó la autorización sanitaria al producto.
9. Declarar que la información de la etiqueta mantiene las mismas condiciones con las cuales fue autorizada y, si ha sufrido cambios, estos se encuentran comunicados oportunamente.
b. De corresponder, adjuntar carta poder simple firmada por el poderdante indicando de manera obligatoria sus nombres, apellidos y número de documento de identidad, salvo que se trate de apoderados con poder inscrito en SUNARP, en cuyo caso basta una Declaración Jurada en los mismos términos establecidos para personas jurídicas.
c. Declaración emitida por el fabricante indicando que las condiciones bajo las cuales fue otorgada la autorización sanitaria se mantienen vigentes, detallando los componentes del producto cuali-cuantitativamente al 100%.
d. Copia del Certificado de libre comercialización o Certificado de registro vigente del producto a autorizar emitido por la Autoridad Competente del país de procedencia; excepcionalmente, en caso el país de origen no emita Certificado de libre comercialización o Certificado de registro del producto, se acepta un documento emitido por la entidad competente del país de origen que certifique los datos del fabricante del producto (en caso de que el producto sea de procedencia extranjera).
15.2. En todos los casos se debe presentar traducción simple, si el documento no se encuentra en castellano.
15.3. El procedimiento administrativo es un procedimiento de evaluación previa con aplicación del silencio administrativo negativo, cuyo pronunciamiento se emite en un plazo no mayor de veinte días hábiles.
15.4. La renovación de la autorización sanitaria para productos químicos de uso industrial (nacional o importado) tiene una vigencia de tres años.
CAPÍTULO V
AUTORIZACIÓN SANITARIA DE DESINFECTANTES DE USO DOMÉSTICO, INDUSTRIAL Y/O EN SALUD PÚBLICA DESTINADOS AL COMERCIO
Artículo 16.- Autorización sanitaria de desinfectantes de uso doméstico, industrial y/o en salud pública destinados al comercio
16.1 La autorización sanitaria para desinfectantes de uso doméstico, industrial y/o en salud pública es el procedimiento administrativo que habilita la fabricación, importación, distribución, comercialización y almacenamiento de desinfectantes de uso doméstico, industrial y/o en salud pública, evaluando su formulación.
16.2 Es condición del presente procedimiento que los productos respecto de los cuales se solicita autorización sanitaria estén destinados a su aplicación en superficies inertes; no pueden ser utilizados para la desinfección de dispositivos médicos o alimentos.
Artículo 17.- Requisitos para la autorización sanitaria de desinfectantes de uso doméstico, industrial y/o en salud pública destinados al comercio
17.1. Para el presente procedimiento administrativo se exigen los siguientes requisitos:
a. Solicitud con carácter de Declaración Jurada, la cual debe contener – como mínimo – la siguiente información:
1. Tratándose de personas jurídicas: Su número de R.U.C. Además, nombre y apellido, teléfono y número de D.N.I. o Carné de Extranjería de su representante legal señalando que su poder se encuentra vigente, consignando el número de Partida Electrónica y asiento de inscripción en la Superintendencia Nacional de los Registros Públicos (SUNARP).
2. Tratándose de personas naturales: Nombre y apellido, número de D.N.I. o Carné de Extranjería.
3. En caso actúe en representación del titular del proyecto, consignar el nombre y apellido y número de D.N.I. o Carné de Extranjería del representante.
4. Domicilio legal del solicitante.
5. Fecha de pago y el número de comprobante del pago por derecho de tramitación.
6. Correo electrónico del solicitante o su representante, en caso autorice se le notifiquen comunicaciones o actos por dicho medio.
7. Nombre comercial y dirección del establecimiento.
b. De corresponder, adjuntar carta poder simple firmada por el poderdante indicando de manera obligatoria sus nombres, apellidos y número de documento de identidad, salvo que se trate de apoderados con poder inscrito en SUNARP, en cuyo caso basta una Declaración Jurada en los mismos términos establecidos para personas jurídicas.
c. Copia del informe de ensayo de toxicidad aguda (oral, dermal e inhalatoria) del producto a autorizar, realizado por un laboratorio acreditado por entidades internacionales, por INACAL u otra entidad acreditadora del país donde se realizó el ensayo.
d. Documento suscrito por profesional competente, conteniendo – como mínimo – la siguiente información:
1. Nombre y dirección del fabricante.
2. Forma de presentación.
3. Tipo y material de envase (cajas, frascos, cartón).
4. Microorganismo objetivo.
5. Dosis de aplicación.
6. Instrucciones de uso y manejo del producto.
7. Advertencias y precauciones.
8. Ámbito de uso.
e. Copia de la Ficha de Datos de Seguridad del producto, emitida por el fabricante y suscrita por el profesional competente.
f. Declaración Jurada emitida por el fabricante detallando los componentes del producto cuali-cuantitativamente al 100%.
g. Copia del documento de ensayo de enfrentamiento microbiano, con una antigüedad no mayor de tres (3) años, precisando la metodología, realizado por un laboratorio acreditado por entidades internacionales, por INACAL u otra entidad acreditadora del país donde se realizó el ensayo.
h. Copia del documento que contenga el proyecto de etiqueta.
i. Copia del Certificado de libre comercialización o Certificado de registro vigente del producto a autorizar emitido por la Autoridad Competente del país de procedencia; excepcionalmente, en caso el país de origen no emita Certificado de libre comercialización o Certificado de registro del producto, se acepta un documento emitido por la entidad competente del país de origen que certifique los datos del fabricante del producto (en caso de que el producto sea de procedencia extranjera).
17.2. En todos los casos se debe presentar traducción simple, si el documento no se encuentra en castellano.
17.3. El procedimiento administrativo es un procedimiento de evaluación previa con aplicación del silencio administrativo negativo, cuyo pronunciamiento se emite en un plazo no mayor de treinta días hábiles.
17.4 La autorización sanitaria para desinfectantes de uso doméstico, industrial o en salud pública de origen nacional o importado destinados al comercio tiene una vigencia de tres años.
CAPÍTULO VI
RENOVACIÓN DE LA AUTORIZACIÓN SANITARIA DE DESINFECTANTES DE USO DOMÉSTICO, INDUSTRIAL Y/O EN SALUD PÚBLICA DESTINADOS AL COMERCIO
Artículo 18.- Renovación de la autorización sanitaria para desinfectante de uso doméstico, industrial y/o en salud pública destinado al comercio
18.1 La renovación de la autorización sanitaria para desinfectantes de uso doméstico, industrial y/o en salud pública destinados al comercio es el procedimiento administrativo que habilita al titular de una autorización sanitaria, ya emitida, a continuar con las actividades de fabricación, importación, distribución, comercialización y almacenamiento de desinfectantes de uso doméstico, industrial y/o en salud pública, siempre y cuando mantenga las características de seguridad, calidad y eficacia con las que fue otorgada inicialmente.
18.2 Es condición del presente procedimiento que los productos respecto de los cuales se solicita autorización sanitaria estén destinados a su aplicación en superficies inertes; no pueden ser utilizados para la desinfección de dispositivos médicos o alimentos.
18.3 La solicitud de renovación puede ser presentada por el titular de la autorización sanitaria hasta sesenta días hábiles anteriores a la fecha de su vencimiento.
Artículo 19.- Requisitos para la renovación de la autorización sanitaria para desinfectante de uso doméstico, industrial y/o en salud pública de origen nacional o importado destinado al comercio
19.1. Para el presente procedimiento administrativo se exigen los siguientes requisitos:
a. Solicitud con carácter de Declaración Jurada, la cual debe contener – como mínimo – la siguiente información:
1. Tratándose de personas jurídicas: Su número de R.U.C. Además, nombre y apellido, teléfono y número de D.N.I. o Carné de Extranjería de su representante legal señalando que su poder se encuentra vigente, consignando el número de Partida Electrónica y asiento de inscripción en la Superintendencia Nacional de los Registros Públicos (SUNARP).
2. Tratándose de personas naturales: Nombre y apellido, número de D.N.I. o Carné de Extranjería.
3. En caso actúe en representación del titular del proyecto, consignar el nombre y apellido y número de D.N.I. o Carné de Extranjería del representante.
4. Domicilio legal del solicitante.
5. Fecha de pago y el número de comprobante del pago por derecho de tramitación.
6. Correo electrónico del solicitante o su representante, en caso autorice se le notifiquen comunicaciones o actos por dicho medio.
7. Nombre comercial y dirección del establecimiento.
8. Número de Resolución Directoral que otorgó la autorización sanitaria al producto.
9. Declarar que la información de la etiqueta mantiene las mismas condiciones con las cuales fue autorizada y, si ha sufrido cambios, estos se encuentran comunicados oportunamente.
b. De corresponder, adjuntar carta poder simple firmada por el poderdante indicando de manera obligatoria sus nombres, apellidos y número de documento de identidad, salvo que se trate de apoderados con poder inscrito en SUNARP, en cuyo caso basta una Declaración Jurada en los mismos términos establecidos para personas jurídicas.
c. Declaración emitida por el fabricante indicando que las condiciones bajo las cuales fue otorgada la autorización sanitaria se mantienen vigentes, detallando los componentes del producto cuali-cuantitativamente al 100%.
d. Copia de documento de ensayo de enfrentamiento microbiano, con una antigüedad no mayor de tres (3) años, precisando la metodología, realizado por un laboratorio acreditado por entidades internacionales, por el Instituto Nacional de Calidad u otra entidad acreditadora del país donde se realizó el ensayo.
e. Copia del Certificado de libre comercialización o Certificado de registro vigente del producto a autorizar emitido por la Autoridad Competente del país de procedencia; excepcionalmente, en caso el país de origen no emita Certificado de libre comercialización o Certificado de registro del producto, se acepta un documento emitido por la entidad competente del país de origen que certifique los datos del fabricante del producto (en caso de que el producto sea de procedencia extranjera).
19.2. En todos los casos se debe presentar traducción simple si el documento no se encuentra en castellano.
19.3. El procedimiento administrativo es un procedimiento de evaluación previa con aplicación del silencio administrativo negativo, cuyo pronunciamiento se emite en un plazo no mayor de veinte días hábiles.
19.4 La renovación de la autorización sanitaria para desinfectante de uso doméstico, industrial y/o en salud pública destinados al comercio tiene una vigencia de tres años.
CAPÍTULO VII
AUTORIZACIÓN SANITARIA PARA PLAGUICIDAS DE USO DOMÉSTICO, INDUSTRIAL Y/O EN SALUD PÚBLICA DESTINADOS AL COMERCIO
Artículo 20.- Autorización sanitaria para plaguicidas de uso doméstico, industrial y/o en salud pública destinado al comercio
20.1 La autorización sanitaria para plaguicida de uso doméstico, industrial y/o en salud pública destinado al comercio es el procedimiento administrativo que habilita la fabricación, importación, distribución, comercialización y almacenamiento de plaguicidas de uso doméstico, industrial y/o en salud pública, evaluando su formulación.
20.2 Es condición del presente procedimiento que los productos respecto de los cuales se solicita autorización sanitaria estén destinados a su aplicación en superficies inertes.
Artículo 21.- Requisitos para la autorización sanitaria para plaguicidas de uso doméstico, industrial y/o en salud pública destinado al comercio
21.1. Para el presente procedimiento administrativo se exigen los siguientes requisitos:
a. Solicitud con carácter de Declaración Jurada, la cual debe contener – como mínimo – la siguiente información:
1. Tratándose de personas jurídicas: Su número de R.U.C. Además, nombre y apellido, teléfono y número de D.N.I. o Carné de Extranjería de su representante legal señalando que su poder se encuentra vigente, consignando el número de Partida Electrónica y asiento de inscripción en la Superintendencia Nacional de los Registros Públicos (SUNARP).
2. Tratándose de personas naturales: Nombre y apellido, número de D.N.I. o Carné de Extranjería.
3. En caso actúe en representación del titular del proyecto, consignar el nombre y apellido y número de D.N.I. o Carné de Extranjería del representante.
4. Domicilio legal del solicitante.
5. Fecha de pago y el número de comprobante del pago por derecho de tramitación.
6. Correo electrónico del solicitante o su representante, en caso autorice se le notifiquen comunicaciones o actos por dicho medio.
7. Nombre comercial y dirección del establecimiento.
b. De corresponder, adjuntar carta poder simple firmada por el poderdante indicando de manera obligatoria sus nombres, apellidos y número de documento de identidad, salvo que se trate de apoderados con poder inscrito en SUNARP, en cuyo caso basta una Declaración Jurada en los mismos términos establecidos para personas jurídicas.
c. Copia del informe de ensayo de toxicidad aguda (oral, dermal e inhalatoria) del producto a autorizar, realizado por un laboratorio acreditado por entidades internacionales, por INACAL u otra entidad acreditadora del país donde se realizó el ensayo.
d. Documento suscrito por profesional competente, conteniendo – como mínimo – la siguiente información:
1. Nombre y dirección del fabricante.
2. Forma de presentación.
3. Tipo y material de envase (cajas, frascos, cartón).
4. Plaga objetivo.
5. Dosis de aplicación.
6. Instrucciones de uso y manejo del producto.
7. Advertencias y precauciones.
8. Ámbito de uso.
e. Copia de la Ficha de Datos de Seguridad del producto, emitida por el fabricante y suscrita por el profesional competente.
f. Declaración Jurada emitida por el fabricante detallando los componentes del producto cuali-cuantitativamente al 100%.
g. Copia del documento sobre Estudios de Eficacia, con una antigüedad no mayor de tres (3) años. Los estudios deben ser desarrollados siguiendo los protocolos y metodologías de la Organización Mundial de la Salud, la Organización Panamericana de la Salud, Ministerio de Salud u otra entidad reconocida internacionalmente.
h. Copia del documento que contenga el proyecto de etiqueta.
i. Copia del Certificado de libre comercialización o Certificado de registro vigente del producto a autorizar emitido por la Autoridad Competente del país de procedencia; excepcionalmente, en caso el país de origen no emita Certificado de libre comercialización o Certificado de registro del producto, se acepta un documento emitido por la entidad competente del país de origen que certifique los datos del fabricante del producto (en caso de que el producto sea de procedencia extranjera).
21.2. En todos los casos se debe presentar traducción simple, si el documento no se encuentra en castellano.
21.3. El procedimiento administrativo es un procedimiento de evaluación previa con aplicación del silencio administrativo negativo, cuyo pronunciamiento se emite en un plazo no mayor de treinta días hábiles.
21.4 La autorización sanitaria para plaguicidas de uso doméstico, industrial y/o en salud pública destinados al comercio tiene una vigencia de tres años.
CAPÍTULO VIII
RENOVACIÓN DE LA AUTORIZACIÓN SANITARIA PARA PLAGUICIDAS DE USO DOMÉSTICO, INDUSTRIAL Y/O EN SALUD PÚBLICA DESTINADOS AL COMERCIO
Artículo 22.- Renovación de la autorización sanitaria para plaguicidas de uso doméstico, industrial y/o en salud pública destinados al comercio
22.1 La renovación de la autorización sanitaria para plaguicidas de uso doméstico, industrial o en salud pública destinados al comercio es el procedimiento administrativo que habilita al titular de una autorización sanitaria, ya emitida, a continuar con las actividades de fabricación, importación, distribución, comercialización y almacenamiento de plaguicidas de uso doméstico, industrial y/o en salud pública, siempre y cuando mantenga las características de seguridad, calidad y eficacia con las que fue otorgada inicialmente.
22.2 Es condición del presente procedimiento que los productos respecto de los cuales se solicita autorización sanitaria estén destinados a su aplicación en superficies inertes.
22.3 La solicitud de renovación puede ser presentada por el titular de la autorización sanitaria hasta sesenta días hábiles anteriores a la fecha de su vencimiento.
Artículo 23.- Requisitos para la renovación de la autorización sanitaria para plaguicidas de uso doméstico, industrial y/o en salud pública de origen nacional o importado destinados al comercio
23.1. Para el presente procedimiento administrativo se exigen los siguientes requisitos:
a. Solicitud con carácter de Declaración Jurada, la cual debe contener – como mínimo – la siguiente información:
1. Tratándose de personas jurídicas: Su número de R.U.C. Además, nombre y apellido, teléfono y número de D.N.I. o Carné de Extranjería de su representante legal señalando que su poder se encuentra vigente, consignando el número de Partida Electrónica y asiento de inscripción en la Superintendencia Nacional de los Registros Públicos (SUNARP).
2. Tratándose de personas naturales: Nombre y apellido, número de D.N.I. o Carné de Extranjería.
3. En caso actúe en representación del titular del proyecto, consignar el nombre y apellido y número de D.N.I. o Carné de Extranjería del representante.
4. Domicilio legal del solicitante.
5. Fecha de pago y el número de comprobante del pago por derecho de tramitación.
6. Correo electrónico del solicitante o su representante, en caso autorice se le notifiquen comunicaciones o actos por dicho medio.
7. Nombre comercial y dirección del establecimiento.
8. Número de Resolución Directoral que otorgó la autorización sanitaria al producto.
9. Declarar que la información de la etiqueta mantiene las mismas condiciones con las cuales fue autorizada y, si ha sufrido cambios, estos se encuentran comunicados oportunamente.
b. De corresponder, adjuntar carta poder simple firmada por el poderdante indicando de manera obligatoria sus nombres, apellidos y número de documento de identidad, salvo que se trate de apoderados con poder inscrito en SUNARP, en cuyo caso basta una Declaración Jurada en los mismos términos establecidos para personas jurídicas.
c. Declaración emitida por el fabricante indicando que las condiciones bajo las cuales fue otorgada la autorización sanitaria se mantienen vigentes, detallando los componentes del producto cuali-cuantitativamente al 100%.
d. Copia del documento sobre Estudios de Eficacia, con una antigüedad no mayor de tres (3) años. Los estudios deben ser desarrollados siguiendo los protocolos y metodologías de la OMS-OPS, MINSA u otra entidad reconocida internacionalmente.
e. Copia del Certificado de libre comercialización o Certificado de registro vigente del producto a autorizar emitido por la Autoridad Competente del país de procedencia; excepcionalmente, en caso el país de origen no emita Certificado de libre comercialización o Certificado de registro del producto, se acepta un documento emitido por la entidad competente del país de origen que certifique los datos del fabricante del producto (en caso de que el producto sea de procedencia extranjera).
23.2. En todos los casos se debe presentar traducción simple si el documento no está en castellano.
23.3. El procedimiento administrativo es un procedimiento de evaluación previa con aplicación del silencio administrativo negativo, cuyo pronunciamiento se emite en un plazo no mayor de veinte días hábiles.
23.4 La renovación de la autorización sanitaria para plaguicidas de uso doméstico, industrial y/o en salud pública destinados al comercio tiene una vigencia de tres años.
CAPÍTULO IX
AUTORIZACIÓN SANITARIA PARA DESINFECTANTES O PLAGUICIDAS DE USO INDUSTRIAL Y/O EN SALUD PÚBLICA IMPORTADOS NO DESTINADOS AL COMERCIO
Artículo 24.- Autorización sanitaria para desinfectantes o plaguicidas de uso industrial y/o en salud pública importados no destinados al comercio
24.1 La autorización sanitaria para desinfectantes o plaguicidas de uso industrial y/o en salud pública importados no destinados al comercio, es el procedimiento administrativo que habilita la importación de estos, con la finalidad de ser utilizados en estudios de investigación, estudios de mercadeo o uso propio del solicitante. Tales productos no deben ser destinados al comercio.
24.2 La presente autorización no permite el uso de especímenes de flora o fauna silvestre en los estudios de investigación, para lo cual se debe cumplir con lo dispuesto por la Ley Nº 29763, Ley Forestal y de Fauna Silvestre; el Reglamento para la Gestión Forestal, aprobado por Decreto Supremo N° 018-2015-MINAGRI; el Reglamento para la Gestión de Fauna Silvestre, aprobado por Decreto Supremo Nº 019-2015-MINAGRI; y, la Ley Nº 30407, Ley de Protección y Bienestar Animal.
Artículo 25.- Requisitos para la autorización sanitaria para desinfectantes o plaguicidas de uso industrial y/o en salud pública importados no destinados al comercio
25.1. Para el presente procedimiento administrativo se exigen los siguientes requisitos:
a. Solicitud con carácter de Declaración Jurada, la cual debe contener – como mínimo – la siguiente información:
1. Tratándose de personas jurídicas: Su número de R.U.C. Además, nombre y apellido, teléfono y número de D.N.I. o Carné de Extranjería de su representante legal señalando que su poder se encuentra vigente, consignando el número de Partida Electrónica y asiento de inscripción en la Superintendencia Nacional de los Registros Públicos (SUNARP).
2. Tratándose de personas naturales: Nombre y apellido, número de D.N.I. o Carné de Extranjería; en caso actúe en representación del titular del proyecto, consignar el nombre y apellido y número de D.N.I. o Carné de Extranjería del representante.
3. Domicilio legal del solicitante.
4. Fecha de pago y el número de comprobante del pago por derecho de tramitación.
5. Correo electrónico del solicitante o su representante, en caso autorice se le notifiquen comunicaciones o actos por dicho medio.
6. Nombre comercial y dirección del establecimiento.
b. De corresponder, adjuntar carta poder simple firmada por el poderdante indicando de manera obligatoria sus nombres, apellidos y número de documento de identidad, salvo que se trate de apoderados con poder inscrito en SUNARP, en cuyo caso basta una Declaración Jurada en los mismos términos establecidos para personas jurídicas.
c. Documento suscrito por profesional competente, conteniendo – como mínimo – la siguiente información:
1. Nombre y dirección del fabricante.
2. Forma de presentación.
3. Tipo y material de envase (cajas, frascos, cartón).
4. Cantidad de muestra a importar que no debe superar 50 kilogramos o 50 litros.
5. Motivo de la importación.
6. Dosis de aplicación.
7. Instrucciones de uso y manejo del producto.
8. Advertencias y precauciones.
d. Copia de la Ficha de Datos de Seguridad del producto, emitida por el fabricante y suscrita por el profesional competente.
e. Declaración Jurada emitida por el importador detallando los componentes del producto cuali-cuantitativamente al 100%.
f. Copia del documento que contenga el proyecto de etiqueta.
25.2. En todos los casos se debe presentar traducción simple, si el documento no se encuentra en castellano.
25.3. El procedimiento administrativo es un procedimiento de evaluación previa con aplicación del silencio administrativo negativo, cuyo pronunciamiento se emite en un plazo no mayor de veinte días hábiles.
25.4 El titular de la autorización sanitaria para desinfectantes o plaguicidas de uso industrial y/o en salud pública importados no destinados al comercio puede importar la cantidad solicitada.
CAPÍTULO X
AUTORIZACIÓN SANITARIA PARA LA IMPORTACIÓN DE PRODUCTOS PELIGROSOS EN EL MARCO DEL CONVENIO DE ROTTERDAM
Artículo 26.- Autorización sanitaria para la importación de productos peligrosos en el marco del Convenio de Rotterdam
26.1 La autorización sanitaria para la importación de productos peligrosos en el marco del Convenio de Rotterdam es el procedimiento administrativo que habilita la importación de productos peligrosos provenientes de países que forman parte del “Convenio de Rotterdam para la aplicación del procedimiento de consentimiento fundamentado previo a ciertos plaguicidas y productos químicos peligrosos objeto de comercio internacional”, con la finalidad de autorizar su ingreso al país para su comercialización o uso. Tales productos peligrosos pueden ser de uso restringido o prohibido en el país de origen, según los términos del Anexo III del mencionado Convenio.
26.2 Los productos peligrosos de competencia del Ministerio del Ambiente y el Servicio Nacional de Sanidad Agraria – SENASA, en el marco del Convenio de Rotterdam, no se encuentran comprendidos dentro de los alcances del presente Capítulo.
Artículo 27.- Requisitos para la autorización sanitaria para la importación de productos peligrosos en el marco del Convenio de Rotterdam
27.1 Para el presente procedimiento administrativo se exigen los siguientes requisitos:
a. Solicitud con carácter de Declaración Jurada, la cual debe contener – como mínimo – la siguiente información:
1. Tratándose de personas jurídicas: Su número de R.U.C. Además, nombre y apellido, teléfono y número de D.N.I. o Carné de Extranjería de su representante legal señalando, con carácter de Declaración Jurada, que su poder se encuentra vigente, consignando el número de Partida Electrónica y asiento de inscripción en la Superintendencia Nacional de Registros Públicos (SUNARP).
2. Tratándose de personas naturales: Nombre y apellido, número de D.N.I. o Carné de Extranjería.
3. En caso actúe en representación del titular del proyecto, consignar el nombre y apellido y número de D.N.I. o Carné de Extranjería del representante.
4. Domicilio legal del solicitante.
5. Fecha de pago y el número de comprobante del pago por derecho de tramitación.
6. Correo electrónico del solicitante o su representante, en caso autorice se le notifiquen comunicaciones o actos por dicho medio.
7. Nombre comercial y dirección del establecimiento.
b. De corresponder, adjuntar carta poder simple firmada por el poderdante indicando de manera obligatoria sus nombres, apellidos y número de documento de identidad, salvo que se trate de apoderados con poder inscrito en SUNARP, en cuyo caso basta una Declaración Jurada en los mismos términos establecidos para personas jurídicas.
c. Plan de manejo del producto desde su internamiento en el país hasta su comercialización o uso y la disposición final de los residuos en caso se generen (el cual debe contener las condiciones de transporte, almacenamiento, manipulación del producto, las medidas contra incendios y la disposición final del producto).
d. Copia de la Ficha de Datos de Seguridad del producto emitida por el fabricante.
e. Documento que indique el uso previsto del producto.
27.2. El procedimiento administrativo es un procedimiento de evaluación previa con aplicación del silencio administrativo negativo, cuyo pronunciamiento se emite en plazo no mayor de veinte días hábiles.
27.3 La autorización sanitaria para la importación de productos peligrosos en el marco del Convenio de Rotterdam tiene una vigencia de un año.
CAPÍTULO XI
MODIFICACIÓN Y AMPLIACIÓN DE LA AUTORIZACIÓN SANITARIA DE DESINFECTANTES O PLAGUICIDAS DE USO DOMÉSTICO, INDUSTRIAL Y/O EN SALUD PÚBLICA DESTINADOS AL COMERCIO
Artículo 28.- Modificación de autorización sanitaria de desinfectantes o plaguicidas de uso doméstico, industrial y/o en salud pública destinados al comercio
28.1 Los titulares de la autorización sanitaria pueden modificar las fragancias y/o colorantes de los productos autorizados, debiendo el producto mantener las mismas condiciones de calidad, seguridad y eficacia según lo autorizado inicialmente; respecto de los siguientes procedimientos administrativos:
a) Modificación de autorización sanitaria de desinfectantes de uso doméstico, industrial y/o en salud pública de procedencia nacional o importado destinados al comercio;
b) Modificación de autorización sanitaria de plaguicidas de uso doméstico, industrial y/o en salud pública de procedencia nacional o importado destinados al comercio.
28.2 La modificación de la autorización sanitaria que se otorga por el presente procedimiento administrativo conserva el número y vigencia de la autorización sanitaria otorgada inicialmente.
Artículo 29.- Requisitos para la modificación de autorización sanitaria de desinfectantes o plaguicidas de uso doméstico, industrial y/o en salud pública destinados al comercio
29.1 Para el presente procedimiento administrativo se exigen los siguientes requisitos:
a. Solicitud con carácter de Declaración Jurada, la cual debe contener – como mínimo – la siguiente información:
1. Tratándose de personas jurídicas: Su número de R.U.C. Además, nombre y apellido, teléfono y número de D.N.I. o Carné de Extranjería de su representante legal señalando que su poder se encuentra vigente, consignando el número de Partida Electrónica y asiento de inscripción en la Superintendencia Nacional de Registros Públicos (SUNARP).
2. Tratándose de personas naturales: Nombre y apellido, número de D.N.I. o Carné de Extranjería.
3. En caso actúe en representación del titular del proyecto, consignar el nombre y apellido y número de D.N.I. o Carné de Extranjería del representante.
4. Domicilio legal del solicitante.
5. Fecha de pago y el número de comprobante del pago por derecho de tramitación.
6. Correo electrónico del solicitante o su representante, en caso autorice se le notifiquen comunicaciones o actos por dicho medio.
7. Nombre comercial y dirección del establecimiento.
8. Número de Resolución Directoral que otorgó la autorización sanitaria al producto.
b. De corresponder, adjuntar carta poder simple firmada por el poderdante indicando de manera obligatoria sus nombres, apellidos y número de documento de identidad, salvo que se trate de apoderados con poder inscrito en SUNARP, en cuyo caso basta una Declaración Jurada en los mismos términos establecidos para personas jurídicas.
c. Declaración Jurada emitida por el fabricante que detalle los componentes del producto cuali-cuantitativamente al 100%, y que indique que mantiene las mismas condiciones bajo las cuales se emitió la autorización sanitaria. En caso corresponda se debe presentar traducción simple si el documento no está en castellano.
29.2. El procedimiento administrativo es un procedimiento de evaluación previa con aplicación del silencio administrativo negativo, cuyo pronunciamiento se emite en un plazo no mayor de quince días hábiles.
Artículo 30.- Ampliación de uso en la autorización sanitaria de desinfectantes o plaguicidas de uso doméstico, industrial y/o en salud pública destinados al comercio
30.1 Los titulares de la autorización sanitaria pueden ampliar la eficacia del producto respecto a otros microorganismos o plagas diferentes a los autorizados, debiendo mantener las mismas condiciones de calidad y seguridad del producto, según lo autorizado inicialmente; respecto de los siguientes procedimientos administrativos:
a) Ampliación de la autorización sanitaria de desinfectantes de uso doméstico, industrial y/o en salud pública de procedencia nacional o importado destinados al comercio;
b) Ampliación de la autorización sanitaria de plaguicidas de uso doméstico, industrial y/o en salud pública de procedencia nacional o importado destinados al comercio.
30.2 La ampliación de la autorización sanitaria que se otorga por el presente procedimiento administrativo conserva el número y vigencia de la autorización sanitaria otorgada inicialmente.
Artículo 31.- Requisitos para la ampliación de uso en la autorización sanitaria de desinfectantes o plaguicidas de uso doméstico, industrial y/o en salud pública destinados al comercio
31.1 Para el presente procedimiento administrativo se exigen los siguientes requisitos:
a. Solicitud con carácter de Declaración Jurada, la cual debe contener – como mínimo – la siguiente información:
1. Tratándose de personas jurídicas: Su número de R.U.C. Además, nombre y apellido, teléfono y número de D.N.I. o Carné de Extranjería de su representante legal señalando que su poder se encuentra vigente, consignando el número de Partida Electrónica y asiento de inscripción en la Superintendencia Nacional de Registros Públicos (SUNARP).
2. Tratándose de personas naturales: Nombre y apellido, número de D.N.I. o Carné de Extranjería.
3. En caso actúe en representación del titular del proyecto, consignar el nombre y apellido y número de D.N.I. o Carné de Extranjería del representante.
4. Domicilio legal del solicitante.
5. Fecha de pago y el número de comprobante del pago por derecho de tramitación.
6. Correo electrónico del solicitante o su representante, en caso autorice se le notifiquen comunicaciones o actos por dicho medio.
7. Nombre comercial y dirección del establecimiento.
8. Número de Resolución Directoral que otorgó la autorización sanitaria al producto.
b. De corresponder, adjuntar carta poder simple firmada por el poderdante indicando de manera obligatoria sus nombres, apellidos y número de documento de identidad, salvo que se trate de apoderados con poder inscrito en SUNARP, en cuyo caso basta una Declaración Jurada en los mismos términos establecidos para personas jurídicas.
c. Copia del documento de ensayo de enfrentamiento microbiano, en caso de desinfectantes, con una antigüedad de tres (3) años, o copia del documento sobre estudios de eficacia, en caso de plaguicidas, que demuestre la eficacia del producto, con una antigüedad mayor a tres (3) años.
d. Copia del documento que contenga el proyecto de etiqueta.
31.2. El procedimiento administrativo es un procedimiento de evaluación previa con aplicación del silencio administrativo negativo, cuyo pronunciamiento se emite en un plazo no mayor de quince días hábiles.
Artículo 32.- Cambio en la composición o formulación
Cuando se realice algún cambio en la composición o formulación de los productos autorizados, se considera que existe un nuevo producto, por tanto, se debe solicitar una nueva autorización sanitaria.
CAPÍTULO XII
SERVICIO PRESTADO EN EXCLUSIVIDAD
Artículo 33.- Certificado de libre venta de sustancias peligrosas de uso doméstico, industrial y/o en salud pública
La emisión del “Certificado de libre venta de sustancias peligrosas de uso doméstico, industrial y/o en salud pública” es un servicio prestado en exclusividad al titular de una autorización sanitaria, por el que se certifica que los productos desinfectantes o plaguicidas de uso doméstico, industrial y/o en salud pública, así como los productos químicos de uso industrial, se encuentran autorizados por la DIGESA.
Artículo 34.- Requisitos para el Certificado de libre venta de sustancias peligrosas de uso doméstico, industrial y/o en salud pública
34.1. Para la prestación del presente servicio prestado en exclusividad se exige una solicitud con carácter de Declaración Jurada, la cual debe contener – como mínimo – la siguiente información:
a) Tratándose de personas jurídicas: Su número de R.U.C. Además, nombre y apellido, teléfono y número de D.N.I. o Carné de Extranjería de su representante legal señalando que su poder se encuentra vigente, consignando el número de Partida Electrónica y asiento de inscripción en la Superintendencia Nacional de los Registros Públicos (SUNARP).
b) Tratándose de personas naturales: Nombre y apellido, número de D.N.I. o Carné de Extranjería, y el nombre y apellido y número de D.N.I. o Carné de Extranjería del representante en caso actúen mediante representación. En este último caso, se debe adjuntar carta poder simple firmada por el poderdante indicando de manera obligatoria sus nombres, apellidos y número de documento de identidad, salvo que se trate de apoderados con poder inscrito en SUNARP, en cuyo caso basta una Declaración Jurada en los mismos términos establecidos para personas jurídicas.
c) Domicilio legal del solicitante.
d) Fecha de pago y el número de comprobante del pago por derecho de tramitación por producto.
e) Correo electrónico del solicitante o su representante, en caso autorice se le notifiquen comunicaciones o actos por dicho medio.
f) Número de la Resolución Directoral de autorización sanitaria.
34.2. El Certificado de libre venta de sustancias peligrosas de uso doméstico, industrial y/o en salud pública se expide en el plazo de cinco días hábiles y tiene vigencia por el periodo por el cual fue otorgada la autorización sanitaria.
CAPÍTULO XIII
REVOCACIÓN, CANCELACIÓN DE LA AUTORIZACIÓN SANITARIA Y AGOTAMIENTO DE STOCK
Artículo 35.- Revocación
Procede la revocación de la autorización sanitaria cuando, de informaciones científicas provenientes de la Organización Mundial de la Salud (OMS), de autoridades reguladoras de otros países o de las acciones de fiscalización y vigilancia sanitaria se determine que las sustancias peligrosas de uso doméstico, industrial y/o en salud pública, son inseguras o ineficaces en su uso en los términos que fueron autorizadas, o pueden afectar la salud de la población.
Artículo 36.- Cancelación
El titular de la autorización sanitaria puede solicitar la cancelación de dicha autorización, en cuyo caso es responsable del recojo del producto que se encuentra comercializándose y de su uso luego de la cancelación.
Artículo 37.- Agotamiento de stock
37.1 El titular de la autorización sanitaria de las sustancias peligrosas de uso doméstico, industrial y/o en salud pública debe comunicar ante la Autoridad Sanitaria competente de nivel nacional el agotamiento de stock en un periodo no mayor de treinta días de haberse producido el hecho que motiva el agotamiento, indicando para ello:
a. Número de resolución administrativa por la que se otorgó autorización sanitaria.
b. Forma de presentación comprendida en el agotamiento del stock.
c. Número de lote comprendido en el agotamiento del stock.
d. Cantidad total del producto a agotar por lote.
37.2 El agotamiento de stock puede aplicarse cuando el titular de la autorización sanitaria realice cambios conforme al Capítulo XI del presente Reglamento o cuando se haya vencido la vigencia de la autorización sanitaria y siempre que el producto no tenga observaciones respecto a su calidad o seguridad sanitaria y aún existan productos en el mercado.
37.3 El periodo máximo para el agotamiento de stock es de doce meses.
TÍTULO III
PROHIBICIONES Y OBLIGACIONES
CAPÍTULO I
SUSTANCIAS PELIGROSAS DE USO DOMÉSTICO, INDUSTRIAL Y/O EN SALUD PÚBLICA
Artículo 38.- Prohibiciones de las sustancias peligrosas de uso doméstico, industrial y/o en salud pública
38.1. Se encuentran prohibidas las actividades relacionadas a sustancias peligrosas de uso doméstico, industrial y/o en salud pública, según el siguiente detalle:
a) La fabricación de las sustancias peligrosas de uso doméstico, industrial y/o en salud pública en predios destinados a casa habitación, mercados de abastos, galerías comerciales, centros comerciales y ferias, por representar riesgo a la salud de la población en conformidad con el artículo 96 de la Ley N° 26842, Ley General de Salud.
b) La fabricación, almacenamiento y comercialización de productos fabricados con sustancias peligrosas de uso doméstico, industrial y/o en salud pública en el mismo ambiente donde se fabriquen, preparen, almacenen, maquilen o vendan alimentos, bebidas y/o medicamentos de uso humano, por representar riesgo a la salud de la población.
38.2. Se encuentran prohibidos en relación a los productos terminados de sustancias peligrosas de uso doméstico, industrial y/o en salud pública, lo siguiente:
a) El uso de sustancias carcinogénicas, teratogénicas, mutagénicas u otras sustancias dañinas para la salud de las personas en la fabricación, importación, distribución, comercialización o almacenamiento de los productos, según lo dispuesto por la OMS, IARC (Grupo 1: “carcinógeno para el ser humano”), ECHA y otras Agencias Internacionales, por representar riesgo a la salud de la población.
b) El uso en el ámbito doméstico de los plaguicidas de las categorías de peligros de toxicidad aguda 1, 2 o 3, según la versión del Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos, adoptada a nivel nacional.
c) El uso en el ámbito industrial y/o en salud pública de los plaguicidas de las categorías de peligros de toxicidad aguda 1 o 2, según la versión del Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos, adoptada a nivel nacional.
d) El uso en el ámbito doméstico, de los desinfectantes clasificados de peligros de toxicidad aguda 1, 2 o 3, según la versión del Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos, adoptada a nivel nacional.
e) El uso en el ámbito industrial o en salud pública de los desinfectantes clasificados en las categorías de peligros de toxicidad aguda 1 o 2, según la versión del Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos, adoptada a nivel nacional.
f) La importación, fabricación, distribución, almacenamiento, comercialización y maquila de productos fabricados con sustancias peligrosas de uso doméstico, industrial y/o en salud pública que contengan en su formulación sustancias enumeradas en el Anexo A del Convenio de Estocolmo sobre Contaminantes Orgánicos Persistentes.
g) La importación, fabricación, distribución, comercialización o maquila de productos en cuya formulación se encuentren sustancias enumeradas en el Anexo III del Convenio de Rotterdam.
h) La importación, fabricación, distribución, comercialización, almacenamiento y maquila de productos fabricados con sustancias peligrosas de uso doméstico, industrial y/o en salud pública cuya formulación contenga mercurio o compuestos de mercurio que contravengan lo establecido en el Convenio de Minamata sobre el Mercurio.
Artículo 39.- Obligaciones de los titulares de las autorizaciones sanitarias de las sustancias peligrosas de uso doméstico, industrial y/o en salud pública
Son obligaciones de los titulares de las autorizaciones sanitarias las siguientes:
a) Informar a la Autoridad Sanitaria competente de nivel nacional cuando se realice algún cambio en la composición o formulación de los productos autorizados cuando se considere que existe un nuevo producto, en cuyo caso, se debe solicitar una nueva autorización sanitaria.
b) Permitir el acceso de los funcionarios, servidores y terceros fiscalizadores a sus dependencias e instalaciones para realizar las actividades de fiscalización.
c) Disponer adecuadamente los residuos procedentes de los establecimientos donde se fabriquen, formulen, envasen o manipulen sustancias peligrosas de uso doméstico, industrial y/o en salud pública, de conformidad con el artículo 99 de la Ley N° 26842, Ley General de Salud; el Decreto Legislativo N° 1278, Decreto Legislativo que aprueba la Ley de Gestión Integral de Residuos Sólidos, su Reglamento y modificatorias; el numeral 10 del artículo 120 de la Ley N° 29338, Ley Recursos Hídricos y su Reglamento; y, con los Convenios internacionales sobre la materia.
d) Cumplir con las demás disposiciones de observancia obligatoria que establece el presente Reglamento y las normas sanitarias que de éste emanen.
TÍTULO IV
FISCALIZACIÓN SANITARIA Y DE LAS INFRACCIONES
CAPÍTULO I
FISCALIZACIÓN SANITARIA
Artículo 40.- Fiscalización sanitaria
40.1. El/la profesional competente es responsable de la conformidad de las especificaciones técnicas de los productos establecidos en el presente Reglamento, así como de las condiciones de fabricación y de calidad exigidas por la Autoridad Sanitaria competente de nivel nacional. Asimismo, es responsable por los efectos adversos comprobados que puedan ocasionar sobre la salud individual o colectiva de los usuarios, además de acompañar en toda la cadena de producción y distribución al titular de la autorización sanitaria.
40.2. El/la representante legal de la empresa titular de la autorización sanitaria es el/la responsable del cumplimiento de los requisitos señalados en el presente Reglamento, así como de responder a los requerimientos de la Autoridad Sanitaria competente de nivel nacional, y contar con los respectivos certificados analíticos y métodos de ensayo necesarios para realizar la verificación de la calidad sanitaria.
40.3. La fiscalización de las sustancias peligrosas de uso doméstico, industrial y/o en salud pública se realiza a los establecimientos destinados a fabricar, maquilar, importar, comercializar, distribuir y almacenar estos productos, y todos los procesos vinculados.
40.4. La Autoridad Sanitaria competente de nivel nacional lleva a cabo la fiscalización a los establecimientos destinados a importar, fabricar, formular, elaborar, maquilar, comercializar, distribuir y almacenar las sustancias peligrosas de uso doméstico, industrial y/o en salud pública, para verificar que cumplan con los requisitos establecidos en el presente Reglamento.
40.5. La Autoridad Sanitaria competente de nivel nacional puede tomar muestras de las sustancias peligrosas de uso doméstico, industrial y/o en salud pública, en los establecimientos destinados a fabricar, maquilar, importar, comercializar, distribuir y almacenar las sustancias peligrosas de uso doméstico, industrial y/o en salud pública, a fin de verificar el cumplimiento de las especificaciones técnicas que informaron en la obtención de la autorización sanitaria, de acuerdo a lo establecido en el presente Reglamento y el Texto Único Ordenado de la Ley N° 27444, Ley del Procedimiento Administrativo General, aprobado por Decreto Supremo N° 004-2019-JUS.
40.6. La Autoridad Sanitaria competente de nivel nacional realiza la actividad de fiscalización de acuerdo a lo estipulado en el Capítulo II, del Título IV del Texto Único Ordenado de la Ley N° 27444, aprobado por el Decreto Supremo N° 004-2019-JUS.
Artículo 41.- Disposición final
La disposición final de las sustancias peligrosas de uso doméstico, industrial y/o en salud pública objeto de fiscalización y regulación del presente Reglamento, cuando estén vencidos o en mal estado, se efectúa de acuerdo con lo establecido en el Decreto Legislativo N° 1278, Decreto Legislativo que aprueba la Ley de Gestión Integral de Residuos Sólidos, su Reglamento y modificatorias; y de conformidad a los convenios internacionales que rigen sobre la materia.
Artículo 42.- Personal que aplica plaguicidas en salud pública
Los plaguicidas en salud pública deben ser aplicados por personal especialmente capacitado y entrenado para tal fin, usando los equipos de protección personal, de acuerdo a las especificaciones del fabricante.
Artículo 43.- Medidas sanitarias de seguridad de las sustancias peligrosas y similares de uso doméstico, industrial y/o en salud pública
43.1. La Autoridad Sanitaria competente de nivel nacional, con base en criterios técnicos acordes a la composición química, peligrosidad derivada por los componentes de la formulación y efectos toxicológicos, puede establecer medidas sanitarias de seguridad con el objeto de prevenir o impedir que las sustancias peligrosas de uso doméstico, industrial y/o en salud pública o una situación particular asociada a su uso o comercialización, atente o pueda significar peligro para la salud de las personas. Las medidas sanitarias de seguridad se aplican sin perjuicio de las sanciones que correspondan.
43.2. La Autoridad Sanitaria competente de nivel nacional puede aplicar una o más de las siguientes medidas sanitarias de seguridad encaminadas a proteger la salud pública:
a) Inmovilización del producto;
b) Decomiso del producto para evitar su comercialización, de ser el caso;
c) Retiro del producto del mercado por parte de la empresa titular de la autorización sanitaria;
d) Destrucción del producto que se encuentre en el almacén de la empresa, por parte de la empresa titular de la autorización sanitaria;
e) Suspensión temporal del título habilitante del producto;
f) Cierre temporal del establecimiento;
g) Cancelación del título habilitante del producto.
Para la determinación y aplicación de la medida de seguridad se tienen en cuenta los principios establecidos en el artículo 132 de la Ley N° 26842, Ley General de Salud.
Asimismo, en los casos de las medidas de seguridad de los literales e) y f) mientras el administrado no levante las observaciones que dan mérito a estas, la autoridad de salud no otorga nuevos títulos habilitantes iguales o de similares características.
43.3. La Autoridad Sanitaria competente de nivel nacional aplica las medidas sanitarias de seguridad correspondientes, teniendo en cuenta la naturaleza del producto, el hecho que origina la violación de las disposiciones vigentes y su efecto sobre la salud de las personas. Las medidas que se adopten deben guardar proporción con el nivel de riesgo sanitario y estar debidamente fundamentadas.
43.4. Para la aplicación de la medida de seguridad la Autoridad Sanitaria competente de nivel nacional levanta un acta en la cual se consigna la firma del representante legal o profesional competente de acuerdo a lo estipulado en el Capítulo II, del Título IV del Texto Único Ordenado de la Ley N° 27444, aprobado por Decreto Supremo N 004-2019-JUS. La negativa a firmar el acta por parte de cualquiera de ellos no invalida dicho documento.
CAPÍTULO II
INFRACCIONES Y SANCIONES
Artículo 44.- Potestad sancionadora
La Dirección General de Salud Ambiental e Inocuidad Alimentaria es la autoridad encargada de ejercer la potestad sancionadora competencia nivel nacional para el ejercicio de las funciones establecidas en el presente Reglamento.
Artículo 45.- Aplicación y rango de las sanciones
45.1. Quienes incurran en infracciones tipificadas en el presente Reglamento, son pasibles de las siguientes sanciones:
a) Amonestación.
b) Cierre temporal o definitivo del establecimiento.
c) Cancelación del título habilitante.
d) Multa comprendida entre 0,5 y 100 Unidades Impositivas Tributarias.
45.2. La aplicación de las sanciones se hace con estricto arreglo a los criterios que señala el artículo 135 de la Ley N° 26842, Ley General de Salud, y al Principio de Razonabilidad establecido en el Texto Único Ordenado de la Ley N° 27444, Ley del Procedimiento Administrativo General.
45.3. De acuerdo a la gravedad de la infracción cometida, se aplica la siguiente escala de sanciones:
a) Infracciones Leves: Amonestación; o multa desde 0,5 hasta 5 Unidades Impositivas Tributarias.
b) Infracciones Graves: Multa desde 6 hasta 15 Unidades Impositivas Tributarias (persona natural) o desde 6 hasta 30 Unidades Impositivas Tributarias (persona jurídica); o, cierre temporal del establecimiento; o, cancelación del título habilitante.
c) Infracciones Muy Graves: Multa desde 16 hasta 50 Unidades Impositivas Tributarias (persona natural) o desde 16 hasta 100 Unidades Impositivas Tributarias (persona jurídica); o, clausura definitiva del establecimiento.
45.4. La ejecución de las Resoluciones de sanción impuestas, se rige de acuerdo al Capítulo IX del Título II del Texto Único Ordenado de la Ley Nº 27444, Ley del Procedimiento Administrativo General, aprobado con Decreto Supremo Nº 004-2019-JUS.
Artículo 46.- Cuadro de infracciones y sanciones
Constituyen infracciones pasibles de sanción el incumplimiento de las normas del presente Reglamento de acuerdo a lo siguiente:
Artículo 47.- Facultades del Indecopi en materia de etiquetado y publicidad
Las facultades que reconoce el presente Reglamento a la Autoridad Sanitaria competente de nivel nacional, en materia de etiquetado de productos y sustancias peligrosas reguladas, no afectan las atribuciones del Instituto Nacional de Defensa de la Competencia y de la Protección de la Propiedad Intelectual – Indecopi, en lo referido al etiquetado de productos para uso o consumo final y publicidad comercial de dichos productos, contenidas en la Ley N° 29571, Código de Protección y Defensa del Consumidor, así como el Decreto Legislativo N° 1044, Ley de Represión de la Competencia Desleal.
Artículo 48.- Facultades del OEFA en materia de fiscalización ambiental
Las facultades que reconoce el presente Reglamento a la Autoridad Sanitaria competente de nivel nacional, en materia de fiscalización sanitaria, no afectan las atribuciones en fiscalización ambiental del OEFA señaladas en el artículo 21 del Decreto Legislativo N° 1570, Decreto Legislativo que aprueba la Ley de Gestión Integral de Sustancias Químicas.
Artículo 49.- Facultades del MTC en materia de autorización y fiscalización del traslado de sustancias peligrosas de la actividad industrial y/o minera
Las facultades que reconoce el presente Reglamento a la Autoridad Sanitaria competente de nivel nacional, en materia de fiscalización sanitaria, no afecta las atribuciones del Ministerio de Transportes y Comunicaciones (MTC) sobre la autorización y fiscalización del traslado de materiales y/o residuos peligrosos de la actividad industrial y/o minera a las Empresas Prestadoras de Servicio de Transporte, reconocidas en la Ley N° 28256, Ley que regula el Transporte Terrestre de Materiales y Residuos Peligrosos.
DISPOSICIÓN COMPLEMENTARIA TRANSITORIA
Única.- Norma aplicable
Las solicitudes de autorización sanitaria para sustancias peligrosas y similares de uso doméstico, industrial y/o en salud pública que, a la entrada en vigencia del presente Reglamento se encuentren en trámite, deben concluir dicho proceso de conformidad a las normas vigentes a la fecha de presentación de las mismas.
ANEXO
ESTRUCTURA DEL PLAN DE MANEJO DEL PRODUCTO
1. Presentación / Introducción.
2. Objetivo
3. Alcance
4. Identificación del producto.
5. Identificación de las actividades desde el internamiento hasta su comercialización o uso y la disposición final de los residuos en caso se generen.
6. Condiciones de transporte, almacenamiento y manipulación del producto conforme lo establecido en el SGA.
7. Estrategias para la prevención y/o minimización de riesgos tal como medidas contra incendios.
8. Gestión y manejo de residuos sólidos para su disposición (en caso se generen).
![Se consideran delitos «especialmente graves» los que tienen una pena de 15 años o más; «graves», los de 8 años o más; y «menos graves», los que están por debajo de los 8 años, todos en su extremo mínimo (precisiones al AP 1-2023) [APE 2-2024/CIJ-112, f. j. 27 (Fe de Erratas)]](https://img.lpderecho.pe/wp-content/uploads/2024/04/palacio-justicia-aguila-LPDerecho-218x150.jpg)
![Niveles de «aminoración» de la pena en casos de tentativa con concurrencia de agravantes específicas: en los delitos «especialmente graves», hasta 1/6 por debajo del mínimo legal; en los «graves», hasta 1/3 por debajo del mínimo legal; y en los «menos graves», hasta una 1/2 por debajo del mínimo legal (precisiones al AP 1-2023) [APE 2-2024/CIJ-112, f. j. 28 (Fe de Erratas)]](https://img.lpderecho.pe/wp-content/uploads/2024/04/palacio-justicia-leon-leones-LPDerecho-218x150.jpg)
![La nulidad en algunos casos es un remedio y en otros un recurso, en la medida que el acto procesal cuestionado este o no contenida en una resolución [Queja NCPP 1577-2022, f. j. 8]](https://img.lpderecho.pe/wp-content/uploads/2024/04/mazo-juez-abogado-civil-corte-sentencia-juicio-penal-LPDerecho-218x150.jpg)

![Ley Orgánica del Registro Nacional de Identificación y Estado Civil (Ley 26497) [actualizada 2025]](https://img.lpderecho.pe/wp-content/uploads/2025/05/Ley-organica-del-registro-nacional-de-identificacion-y-estado-civil1-LPDERECHO-218x150.jpg)











![[VIVO] Clase gratuita sobre Principales modificaciones al régimen de Propiedad Horizontal incorporadas por el Decreto Legislativo 1568. Llena el formulario para recibir las diapositivas](https://img.lpderecho.pe/wp-content/uploads/2025/07/MASCARA-PRINCIPALES-PROPIEDAD-FREDY-SILVA-218x150.jpg)
![Si una donación quedó sólo en minuta (y no llegó a formalizarse en la escritura publica) por la muerte sobrevenida del donante, no debe declararse la nulidad del acto jurídico [Exp. 00010-2024-AA/TC]](https://img.lpderecho.pe/wp-content/uploads/2024/04/abogado-justicia-sentencia-defensa-juicio-civil-penal-escritura-defensa-LPDerecho-218x150.jpg)


![Trabajador considerado como indispensable no puede ir a huelga [Casación 10069-2022, Lima Este] Sindicato](https://img.lpderecho.pe/wp-content/uploads/2023/02/sindicato-despido-huelga-trabajadores-LPDerecho-218x150.png)
![¿Cuándo puede imputarse válidamente una falta por negligencia en el desempeño de funciones? [Informe Técnico 001327-2025-Servir-GPGSC]](https://img.lpderecho.pe/wp-content/uploads/2025/03/SERVIR-LPDERECHO-218x150.jpg)

![Precedente sobre la acreditación del nexo causal entre la no entrega del RISST y el accidente laboral [Resolución Sala Plena 006-2025-Sunafil/TFL]](https://img.lpderecho.pe/wp-content/uploads/2021/07/Inspector-Sunafil-LP-218x150.png)


![Voto singular: Cuando el Convenio 169 de la OIT establece la obligación de consulta previa de «medidas legislativas», se refiere solo a la consulta de actos normativos del Poder Ejecutivo y de los gobiernos regionales y locales [Exp. 00002-2024-PI/TC, 00003-2024-PI/TC y 00005-2024-PI/TC]](https://img.lpderecho.pe/wp-content/uploads/2025/07/PEDRO-HERNANDEZ2-TC-LPDERECHO-218x150.jpg)
![Lineamientos para el proceso de nombramiento del personal de salud [DS 014-2025-SA]](https://img.lpderecho.pe/wp-content/uploads/2024/04/personal-salud-enfermeros-doctores-cirujanos-LPDerecho-218x150.jpg)
![Proyecto de presupuesto multianual 2026-2028 del Poder Judicial [RA 000242-2025-CE-PJ]](https://img.lpderecho.pe/wp-content/uploads/2024/03/placio-de-justicia-pj-poder-judicial-fachada-LPDerecho-218x150.jpg)
![Aprueban nuevos montos de la remuneración del personal militar y policial [Decreto Supremo 148-2025-EF] Policia y fuerzas armadas - LPDerecho](https://img.lpderecho.pe/wp-content/uploads/2022/10/Policia-y-fuerzas-armadas-LPDerecho-218x150.png)
![Reglamento de la Ley 30364 (Decreto Supremo 009-2016-MIMP) [actualizado 2025]](https://img.lpderecho.pe/wp-content/uploads/2024/07/Reglamento-de-la-Ley-30364-LPDERECHO-218x150.jpg)

![Código Procesal Penal peruano [actualizado 2025]](https://img.lpderecho.pe/wp-content/uploads/2024/02/VENTA-CODIGO-PENAL-BANNER-POST-TAPA-DURA-LPDERECHO-218x150.jpg)
![Reglamento sobre encuestas electorales durante los procesos electorales [Resolución 0107-2025-JNE]](https://img.lpderecho.pe/wp-content/uploads/2025/05/REGLAMENTO-ENCUESTAS-ELECTORALES-LPDERECHO-1-218x150.jpg)
![Diseño de la cédula de sufragio para la Consulta Popular de Revocatoria del Mandato de Autoridades Municipales 2025 [Resolución Jefatural 000031-2025-JN/ONPE]](https://img.lpderecho.pe/wp-content/uploads/2025/05/DISENO-CELULA-SUFRAGIO-REVOCATORIA-LPDERECHO-218x150.jpg)




![[VIDEO] Juez propone que todos los delitos se tramiten en unidades de flagrancia, sin excepción](https://img.lpderecho.pe/wp-content/uploads/2025/05/DELITOS-PLANTEA-TABOA-LPDERECHO-218x150.jpg)
![[VIDEO] Hay jueces que rechazan cautelares porque «el caso es complejo», advierte Giovanni Priori en LP](https://img.lpderecho.pe/wp-content/uploads/2025/05/JUECES-RECHAZAN-CAUTELARES-GIOVANNI-LPDERECHO-218x150.jpg)
![[VIDEO] Pedro Castillo podría buscar asilo político si enfrenta el juicio en libertad, advierten Benji Espinoza y Elio Riera](https://img.lpderecho.pe/wp-content/uploads/2025/05/PEDRO-CASTILLO-ASILO-ABOGADOS-LPDERECHO-218x150.jpg)




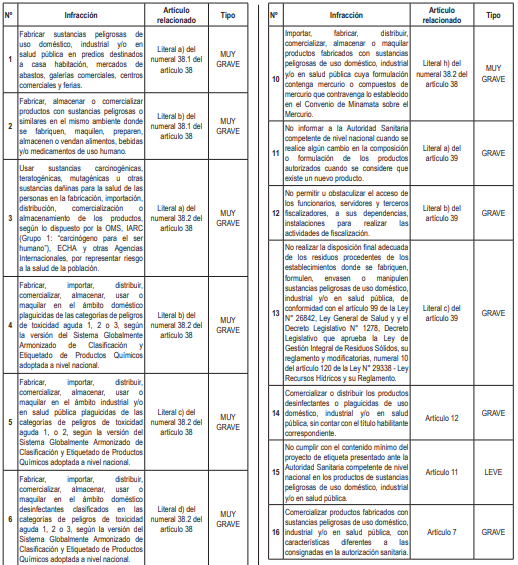
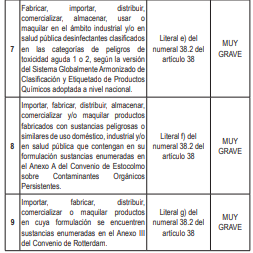

![Multan a Manzana Verde por cláusula abusiva que limitaba devoluciones a consumidores [Res. 1788-2025/SPC-Indecopi]](https://img.lpderecho.pe/wp-content/uploads/2025/07/manzana-verde-indecopi-clausulas-abusivas-LPDerecho-218x150.jpg)
![PJ realizará maratón judicial de descarga procesal [Resolución Administrativa 000241-2025-CE-PJ]](https://img.lpderecho.pe/wp-content/uploads/2024/03/placio-de-justicia-pj-poder-judicial-fachada-2-LPDerecho-218x150.jpg)

![Cuestionan al presidente del INPE luego de ser multado por recibir pago de $3500 y no cumplir con el trabajo prometido a su cliente [Res. 2304-2024/SPC-Indecopi]](https://img.lpderecho.pe/wp-content/uploads/2025/07/IVAN-PAREDES-YATACO-LPDERECHO-100x70.jpg)
![Código Penal peruano [actualizado 2025]](https://img.lpderecho.pe/wp-content/uploads/2024/05/VENTA-CODIGO-PENAL-LPDERECHO-100x70.jpg)
![Si una donación quedó sólo en minuta (y no llegó a formalizarse en la escritura publica) por la muerte sobrevenida del donante, no debe declararse la nulidad del acto jurídico [Exp. 00010-2024-AA/TC]](https://img.lpderecho.pe/wp-content/uploads/2024/04/abogado-justicia-sentencia-defensa-juicio-civil-penal-escritura-defensa-LPDerecho-100x70.jpg)
![Código Procesal Penal peruano [actualizado 2025]](https://img.lpderecho.pe/wp-content/uploads/2024/02/VENTA-CODIGO-PENAL-BANNER-POST-TAPA-DURA-LPDERECHO-100x70.jpg)
![[VIVO] Clase gratuita sobre Principales modificaciones al régimen de Propiedad Horizontal incorporadas por el Decreto Legislativo 1568. Llena el formulario para recibir las diapositivas](https://img.lpderecho.pe/wp-content/uploads/2025/07/MASCARA-PRINCIPALES-PROPIEDAD-FREDY-SILVA-324x160.jpg)


![Se consideran delitos «especialmente graves» los que tienen una pena de 15 años o más; «graves», los de 8 años o más; y «menos graves», los que están por debajo de los 8 años, todos en su extremo mínimo (precisiones al AP 1-2023) [APE 2-2024/CIJ-112, f. j. 27 (Fe de Erratas)]](https://img.lpderecho.pe/wp-content/uploads/2024/04/palacio-justicia-aguila-LPDerecho-100x70.jpg)
![Niveles de «aminoración» de la pena en casos de tentativa con concurrencia de agravantes específicas: en los delitos «especialmente graves», hasta 1/6 por debajo del mínimo legal; en los «graves», hasta 1/3 por debajo del mínimo legal; y en los «menos graves», hasta una 1/2 por debajo del mínimo legal (precisiones al AP 1-2023) [APE 2-2024/CIJ-112, f. j. 28 (Fe de Erratas)]](https://img.lpderecho.pe/wp-content/uploads/2024/04/palacio-justicia-leon-leones-LPDerecho-100x70.jpg)

![[VIVO] Clase gratuita sobre Principales modificaciones al régimen de Propiedad Horizontal incorporadas por el Decreto Legislativo 1568. Llena el formulario para recibir las diapositivas](https://img.lpderecho.pe/wp-content/uploads/2025/07/MASCARA-PRINCIPALES-PROPIEDAD-FREDY-SILVA-100x70.jpg)




![Multan a Falabella por llamar a usuarios sin su consentimiento [lea la resolución] multan-falabella-llamar-usuarios-sin-consentimiento-lea-la-resolucion-LPDERECHO](https://img.lpderecho.pe/wp-content/uploads/2021/06/multan-falabella-llamar-usuarios-sin-consentimiento-lea-la-resolucion-LPDERECHO-324x160.jpg)