Decreto Supremo que modifica el Reglamento de Establecimientos Farmacéuticos
DECRETO SUPREMO N° 004-2021-SA
EL PRESIDENTE DE LA REPÚBLICA
CONSIDERANDO:
Que, el numeral 6) del artículo 3 del Decreto Legislativo N° 1161, Ley de Organización y Funciones del Ministerio de Salud, establece que el Ministerio de Salud es competente en productos farmacéuticos y sanitarios, dispositivos médicos y establecimientos farmacéuticos;
Que, el artículo 4 del precitado Decreto Legislativo dispone que el Sector Salud está conformado por el Ministerio de Salud, como organismo rector, las entidades adscritas a él y aquellas instituciones públicas y privadas de nivel nacional, regional y local, y personas naturales que realizan actividades vinculadas a las competencias establecidas en dicha Ley, y que tienen impacto directo o indirecto en la salud, individual o colectiva;
Que, los literales b) y h) del artículo 5 del acotado Decreto Legislativo, modificado por el Decreto Legislativo N° 1504, Decreto Legislativo que fortalece al Instituto Nacional de Salud para la prevención y control de las enfermedades, establecen que son funciones rectoras del Ministerio de Salud, formular, planear, dirigir, coordinar, ejecutar, supervisar y evaluar la política nacional y sectorial de promoción de la salud, vigilancia, prevención y control de las enfermedades, recuperación, rehabilitación en salud, tecnologías en salud y buenas prácticas en salud, bajo su competencia, aplicable a todos los niveles de gobierno; así como, dictar normas y lineamientos técnicos para la adecuada ejecución y supervisión de la política nacional y políticas sectoriales de salud, entre otros;
Que, la Ley N° 29459, Ley de los Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios, regula las actuaciones de las personas naturales o jurídicas que intervienen en la fabricación, importación, exportación, almacenamiento, distribución, comercialización, promoción, publicidad, prescripción, atención farmacéutica, expendio, uso y destino final de los productos farmacéuticos, dispositivos médicos y productos sanitarios;
Que, el Reglamento de Establecimientos Farmacéuticos, aprobado por Decreto Supremo Nº 014-2011-SA, establece las condiciones técnicas y sanitarias a las que hace referencia la Ley N° 29459, desarrollando en los títulos y capítulos que comprende, aspectos generales y especiales para el funcionamiento de los establecimientos farmacéuticos, el control y vigilancia sanitaria, así como la tipificación de las infracciones y sanciones;
Que, el numeral 2.12 del artículo 2 del Decreto Legislativo N° 1310, Decreto Legislativo que aprueba medidas adicionales de simplificación administrativa, incorporado por Decreto Legislativo N° 1448, establece que como resultado del Análisis de Calidad Regulatoria las entidades del Poder Ejecutivo, cuando corresponda, quedan obligadas a adecuar y depurar las disposiciones normativas que establecían los procedimientos administrativos no ratificados; así como emitir las disposiciones normativas para eliminar o simplificar requisitos;
Que, mediante Decreto Supremo N° 118-2019-PCM se ratifican los procedimientos administrativos cuya competencia corresponde, entre otros, al Ministerio de Salud, disponiendo en sus artículos 2 y 6 que se emitan o gestionen la emisión de las disposiciones normativas para eliminar y simplificar los requisitos de los procedimientos administrativos señalados en el anexo del mencionado Decreto Supremo; y, que las entidades públicas, sin perjuicio del Análisis de Calidad Regulatoria efectuado, deben continuar con su labor de simplificación administrativa, mejorando sus procedimientos y procesos con el objetivo de reducir tiempos y costos a los administrados, respectivamente;
Que, en virtud a lo antes expuesto, resulta necesario modificar los artículos 16, 18, 22, 23, 24, 27, 38, 71, 75, 95, 109, 116 y 125, y el Anexo 1: Escala por Infracciones y sanciones a los establecimientos farmacéuticos y no farmacéuticos del Reglamento de Establecimientos Farmacéuticos, aprobado por Decreto Supremo N° 014-2011-SA, así como dictar otras disposiciones en el marco de la mejora de los niveles de eficiencia de la gestión del Estado, a efectos de simplificar los trámites que han de realizar los administrados respecto al funcionamiento de los establecimientos farmacéuticos, para una mejor atención al ciudadano;
De conformidad con lo establecido en el inciso 8 del artículo 118 de la Constitución Política del Perú, el Decreto Ley Nº 25629, el Decreto Ley Nº 25909 y la Ley Nº 29158, Ley Orgánica del Poder Ejecutivo;
DECRETA:
Artículo 1.- Modificación de los artículos 16, 18, 22, 23, 24, 27, 38, 71, 75, 95, 109, 116 y 125 del Reglamento de Establecimientos Farmacéuticos
Modifíquense los artículos 16, 18, 22, 23, 24, 27, 38, 71, 75, 95, 109, 116 y 125 del Reglamento de Establecimientos Farmacéuticos, aprobado por Decreto Supremo Nº 014-2011-SA, conforme al siguiente detalle:
Artículo 16.- Renuncia o nueva Dirección técnica, Jefatura de Producción, Jefatura de Control de Calidad, Jefatura de Aseguramiento de la Calidad o Químico Farmacéutico asistente
Cuando el profesional Químico Farmacéutico u otros profesionales comprendidos en el Artículo 12 del presente Reglamento, renuncie a la dirección técnica, jefatura de producción, jefatura de control de calidad o jefatura de aseguramiento de la calidad, la renuncia debe ser comunicada por parte del profesional antes referido, a la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM), al Órgano Desconcentrado de la Autoridad Nacional de Salud (OD) o a la Autoridad Regional de Salud (ARS) correspondiente, a través de la Autoridad de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios de nivel regional (ARM), dentro del plazo máximo de diez (10) días calendario, contados a partir de ocurrido el hecho, bajo responsabilidad; debiendo adjuntar copia simple de la renuncia de la dirección técnica, jefatura de producción, jefatura de control de calidad, jefatura de aseguramiento de la calidad o Químico Farmacéutico asistente, presentada al propietario o representante legal del establecimiento, o declaración jurada de no laborar en el establecimiento farmacéutico, señalando la fecha de la renuncia.
En caso de nueva dirección técnica, jefatura de producción, jefatura de control de calidad, jefatura de aseguramiento de la calidad o Químico Farmacéutico asistente, deben ser previamente comunicados al inicio de sus funciones por parte del establecimiento farmacéutico, a la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM), al Órgano Desconcentrado de la Autoridad Nacional de Salud (OD) o la Autoridad Regional de Salud (ARS) correspondiente, a través de la Autoridad de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios de nivel regional (ARM). La comunicación debe ser suscrita por el propietario o representante legal del establecimiento farmacéutico y por el profesional que asume la dirección técnica, jefatura o Químico Farmacéutico asistente del mismo.
El establecimiento farmacéutico no debe funcionar si no cuenta con Director Técnico.
Artículo 18.- Requisitos para la Autorización Sanitaria de Funcionamiento
El propietario o representante legal del establecimiento farmacéutico, para solicitar la Autorización Sanitaria de Funcionamiento, debe presentar los siguientes documentos, según se trate de:
A.- OFICINAS FARMACÉUTICAS: FARMACIAS O BOTICAS
a) Solicitud de autorización con carácter de declaración jurada, en la que debe consignarse, la siguiente información:
– Nombres y apellidos o razón social, así como domicilio y número de Registro Único del Contribuyente (RUC) de la persona natural o jurídica propietaria del establecimiento;
– Nombre del representante legal, en caso de ser persona jurídica;
– Nombre comercial y dirección del establecimiento;
– Nombre y número de colegiatura del profesional Químico Farmacéutico que asume la dirección técnica;
– Nombres y números de colegiatura de los profesionales Químico Farmacéuticos asistentes;
– Horario de atención del establecimiento, del Director Técnico y de los profesionales Químico Farmacéuticos asistentes.
b) Croquis de distribución interna del establecimiento farmacéutico, indicando los metrajes de cada área, en formato A-3; y,
c) Si la farmacia o botica va a realizar preparados farmacéuticos, croquis de distribución interna del área de preparados, en formato A-3.
Las farmacias y boticas que realizan preparados farmacéuticos como preparados homeopáticos, herbarios, cosméticos, dermatológicos u otros, se consideran como oficina farmacéutica especializada, debiendo solicitar autorización previa para la realización de estos preparados al Órgano Desconcentrado de la Autoridad Nacional de Salud (OD) o a la Autoridad Regional de Salud (ARS), a través de la Autoridad de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios de nivel regional (ARM). Dichos establecimientos deben cumplir, además de los requisitos exigidos para farmacias o boticas, las condiciones establecidas en las directivas específicas para cada tipo de preparado que la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM) disponga.
Asimismo, se consideran como oficina farmacéutica especializada, los establecimientos farmacéuticos que se especializan en la comercialización de algún tipo de producto farmacéutico o dispositivo médico terminado, según clasificación terapéutica, dichos establecimientos deben cumplir, además de los requisitos exigidos para farmacias o boticas, las condiciones establecidas en las directivas específicas que la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM) disponga.
B.- FARMACIA DE LOS ESTABLECIMIENTOS DE SALUD
a) Solicitud de autorización sanitaria con carácter de declaración jurada, en la que debe consignarse la siguiente información:
– Razón social y número de Registro Único del Contribuyente (RUC) del establecimiento de salud del cual procede;
– Nombre del responsable del establecimiento de salud;
– Dirección de la farmacia del establecimiento de salud;
– Nombre y número de colegiatura del profesional Químico Farmacéutico que asume la dirección técnica de la farmacia del establecimiento de salud;
– Nombres y números de colegiatura de los profesionales Químico Farmacéuticos de áreas técnicas, según corresponda;
– Nombres y números de colegiatura de los profesionales Químico Farmacéuticos asistentes;
– Horario de atención de la farmacia del establecimiento de salud, del Director Técnico y de los profesionales Químico Farmacéuticos asistentes.
b) Croquis de distribución interna de la farmacia de los establecimientos de salud, incluyendo las áreas técnicas de la unidad productora de servicio, indicando los metrajes de cada área, en formatos A-3.
C.- BOTIQUINES:
a) Solicitud de autorización con carácter de declaración jurada, en la que debe consignarse la siguiente información:
– Nombres y apellidos o razón social, así como domicilio y número de Registro Único del Contribuyente (RUC) de la persona natural o jurídica propietaria del establecimiento;
– Nombre del representante legal, en caso de ser persona jurídica;
– Dirección del botiquín;
– Nombre y número de colegiatura del profesional Químico Farmacéutico que asume la dirección técnica;
– Horario de atención del establecimiento y del Director Técnico;
– Nombre del técnico de farmacia o técnico en Salud.
b) Croquis de distribución interna del botiquín, indicando los metrajes de cada área, en formato A-3.
Los Órganos Desconcentrados de la Autoridad Nacional de Salud (OD) y las Autoridades Regionales de Salud (ARS), a través de las Autoridades de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios de nivel regional (ARM), previo al otorgamiento de la Autorización Sanitaria de Funcionamiento, solicitan la opinión técnica del profesional Químico Farmacéutico perteneciente a la Microrred o Red de Salud donde se encuentre instalado el botiquín, respecto de su ubicación y necesidad de instalación.
D.- DROGUERÍAS:
a) Solicitud de autorización con carácter de declaración jurada, según formato, en la que debe consignarse, entre otras, la siguiente información:
– Nombres y apellidos o razón social, así como domicilio y número de Registro Único del Contribuyente (RUC) de la persona natural o jurídica propietaria del establecimiento;
– Nombre del representante legal, en caso de ser persona jurídica;
– Nombre comercial y dirección del establecimiento;
– Clasificación de productos o dispositivos que comercializará, según artículo 6 de la Ley Nº 29459;
– Nombre y número de colegiatura del profesional Químico Farmacéutico o, de ser el caso, de otro profesional que asume la dirección técnica;
– Nombres y números de colegiatura de los profesionales Químico Farmacéuticos asistentes;
– Horario de funcionamiento del establecimiento, del Director Técnico y de los profesionales Químico Farmacéuticos asistentes.
b) Croquis de distribución interna del almacén, indicando el volumen útil de almacenamiento máximo en metros cúbicos por cada área, exclusiva o compartida y las áreas destinadas a productos o dispositivos que requieren condiciones especiales de almacenamiento, cuando corresponda, en formatos A-3.
E.- ALMACÉN ESPECIALIZADO:
a) Solicitud de autorización con carácter de declaración jurada, en la que debe consignarse, entre otras, la siguiente información:
– Razón social, nombre y número de Registro Único del Contribuyente (RUC) de la institución pública o establecimiento de salud público;
– Nombre del representante legal de la institución pública o establecimiento de salud público;
– Dirección del almacén especializado;
– Clasificación de productos o dispositivos que almacenará y/o distribuirá, según artículo 6 de la Ley Nº 29459;
– Nombre y número de colegiatura del profesional Químico Farmacéutico que asume la dirección técnica del almacén especializado;
– Nombres y números de colegiatura de los profesionales Químico Farmacéuticos asistentes;
– Horario de atención del almacén especializado, del Director Técnico y de los profesionales Químico Farmacéuticos asistentes.
b) Croquis de distribución interna del almacén especializado, indicando el volumen útil de almacenamiento máximo en metros cúbicos por cada área y las áreas destinadas a productos que requieren condiciones especiales de almacenamiento, cuando corresponda, en formatos A-3.
F.- LABORATORIOS DE PRODUCTOS FARMACÉUTICOS:
a) Solicitud de autorización con carácter de declaración jurada, en la que debe consignarse, entre otras, la siguiente información:
– Nombres y apellidos o razón social, así como domicilio y número de Registro Único del Contribuyente (RUC) de la persona natural o jurídica propietaria del establecimiento;
– Nombre del representante legal, en caso de ser persona jurídica;
– Nombre comercial y dirección del establecimiento;
– Áreas de producción, almacenamiento y formas farmacéuticas a fabricar;
– Nombre y número de colegiatura del Director Técnico;
– Nombres y números de colegiatura de los profesionales a cargo de las jefaturas de las áreas de producción, control de calidad y aseguramiento de la calidad que laboran en el establecimiento;
– Horario de funcionamiento del establecimiento, del Director Técnico y de los profesionales a cargo de las jefaturas de las áreas de producción, control de calidad y aseguramiento de la calidad que laboran en el establecimiento.
b) Croquis de distribución de las áreas de laboratorio. En el área de almacenamiento, indicar el volumen útil de almacenamiento máximo en metros cúbicos por cada área, como mínimo, en formatos A-3.
Para laboratorios de producción de gases medicinales, el área de almacenamiento es indicada en metros cuadrados;
c) Diagrama de flujo de los procesos de producción, por forma farmacéutica, indicando los controles de calidad por cada etapa del proceso;
d) Croquis de los sistemas de apoyo crítico, excepto para los laboratorios de producción de gases medicinales;
e) Relación de equipos críticos para la producción y control de calidad.
G.- LABORATORIOS DE DISPOSITIVOS MÉDICOS:
a) Solicitud de autorización con carácter de declaración jurada, en la que debe consignarse, entre otras, la siguiente información:
– Nombres y apellidos o razón social, así como domicilio y número de Registro Único del Contribuyente (RUC) de la persona natural o jurídica propietaria del establecimiento;
– Nombre del representante legal, en caso de ser persona jurídica;
– Nombre comercial y dirección del establecimiento;
– Áreas de producción y almacenamiento, según tipo de proceso;
– Nombre y número de colegiatura del Director Técnico;
– Nombres y números de colegiatura de los profesionales a cargo de las jefaturas de las áreas de producción, control de calidad y aseguramiento de la calidad que laboran en el establecimiento;
– Horario de funcionamiento del establecimiento, del Director Técnico y de los profesionales a cargo de las jefaturas de las áreas de producción, control de calidad y aseguramiento de la calidad que laboran en el establecimiento.
b) Croquis de distribución de las áreas de laboratorio. En el área de almacenamiento, indicar el volumen útil de almacenamiento máximo en metros cúbicos por cada área, como mínimo, en formatos A-3;
c) Diagrama de flujo de los procesos de producción, indicando los controles de calidad por cada etapa del proceso;
d) Croquis de los sistemas de apoyo crítico;
e) Relación de equipos críticos para la producción y control de calidad;
f) Para laboratorios que fabrican equipos biomédicos de tecnología controlada que emitan radiaciones ionizantes debe presentar una autorización emitida por el Instituto Peruano de Energía Nuclear-IPEN.
H.- LABORATORIOS DE PRODUCTOS SANITARIOS:
a) Solicitud de autorización con carácter de declaración jurada, en la que debe consignarse, entre otras, la siguiente información:
– Nombres y apellidos o razón social, así como domicilio y número de Registro Único del Contribuyente (RUC) de la persona natural o jurídica propietaria del establecimiento;
– Nombre del representante legal, en caso de ser persona jurídica;
– Nombre comercial y dirección del establecimiento;
– Áreas de producción, según forma cosmética, y áreas de almacenamiento, para el caso de productos cosméticos. Para los demás productos sanitarios, áreas de producción, según tipo de proceso, y áreas de almacenamiento;
– Nombre y número de colegiatura del Director Técnico;
– Nombres y números de colegiatura de los profesionales a cargo de las jefaturas de las áreas de producción, control de calidad y aseguramiento de la calidad que laboran en el establecimiento;
– Horario de funcionamiento del establecimiento, del Director Técnico y de los profesionales a cargo de las jefaturas de las áreas de producción, control de calidad y aseguramiento de la calidad que laboran en el establecimiento.
b) Croquis de distribución de las áreas de laboratorio. En el área de almacenamiento, indicar el volumen útil de almacenamiento máximo en metros cúbicos por cada área, como mínimo, en formatos A-3;
c) Diagrama de flujo de los procesos de producción por forma cosmética. Para los demás productos sanitarios, según tipo de procesos;
d) Croquis de los sistemas de apoyo crítico;
e) Relación de equipos críticos para la producción y control de calidad.
Para el caso de la Autorización Sanitaria de un laboratorio que se dedique exclusivamente al análisis de control de calidad de productos farmacéuticos, dispositivos médicos o productos sanitarios, deben presentarse los siguientes requisitos:
a) Solicitud de autorización con carácter de declaración jurada, en la que debe consignarse, entre otras, la siguiente información:
– Nombres y apellidos o razón social, así como domicilio y número de Registro Único del Contribuyente (RUC) de la persona natural o jurídica propietaria del establecimiento;
– Nombre del representante legal, en caso de ser persona jurídica;
– Nombre comercial y dirección del establecimiento;
– Nombre y número de colegiatura del Director Técnico del laboratorio de control de calidad;
– Horario de funcionamiento del establecimiento y del Director Técnico.
b) Croquis de distribución interna del laboratorio de control de calidad, indicando el nombre de las áreas, en formato A-3;
c) Tipo de análisis a realizar;
d) Relación de instrumental, materiales y equipos para el control de calidad.
Artículo 22.- De los cambios, modificaciones o ampliaciones de la información declarada
Los cambios, modificaciones o ampliaciones de la información declarada deben ser solicitados por el interesado y aprobados por la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM), el Órgano Desconcentrado de la Autoridad Nacional de Salud (OD) o la Autoridad Regional de Salud (ARS) correspondiente, a través de la Autoridad de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios de nivel regional (ARM), presentando, para estos efectos, los documentos que sustenten la solicitud. Se exceptúan los casos en que el Reglamento prevé expresamente que los cambios o modificaciones sean comunicados.
La autorización sanitaria para la ampliación de almacén de droguería o de almacén especializado se sujeta a los requisitos correspondientes a la Autorización Sanitaria de Funcionamiento. La autorización sanitaria para la ampliación de almacén de laboratorio se sujeta a los requisitos de autorización sanitaria de ampliación de almacén de droguería.
La autorización sanitaria para la ampliación de planta o de un área de producción o área de control de calidad de laboratorio se sujeta a los requisitos de la Autorización Sanitaria de Funcionamiento, según tipo de laboratorio.
Para la solicitud de cambios o modificaciones de la información declarada, se deben presentar los siguientes documentos:
a) Solicitud con carácter de declaración jurada;
b) Copia del documento que sustente el cambio, cuando corresponda.
Los cambios de nombre comercial, razón social y representantes legales del establecimiento farmacéutico; de horarios del Director Técnico, del Químico Farmacéutico asistente y de las jefaturas; así como de la dirección de la oficina administrativa u otros que defina la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM), deben ser previamente comunicados a la ANM, al Órgano Desconcentrado de la Autoridad Nacional de Salud (OD) o la Autoridad Regional de Salud (ARS) correspondiente, a través de la Autoridad de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios de nivel regional (ARM), adjuntando copia del documento que sustente el cambio; procediendo automáticamente dichos cambios y no siendo necesario que la Autoridad correspondiente emita pronunciamiento alguno.
Artículo 23.- De los cierres temporales y definitivos de los establecimientos farmacéuticos
El cierre temporal o definitivo del establecimiento farmacéutico, deben ser comunicados a la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM), al Órgano Desconcentrado de la Autoridad Nacional de Salud (OD), o a la Autoridad Regional de Salud (ARS) correspondiente a través de la Autoridad de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios de nivel regional (ARM), previo a la fecha de su inicio del cierre, especificando el área o áreas materia de cierre. En el caso de cierre definitivo, en la comunicación, además, debe declararse que no se cuenta con existencia de productos, dispositivos, insumos, materiales y equipos, según corresponda.
La Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM), el Órgano Desconcentrado de la Autoridad Nacional de Salud (OD) o la Autoridad Regional de Salud (ARS) correspondiente a través de la Autoridad de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios de nivel regional (ARM), previo al cierre definitivo, verificarán la tenencia o devolución de sustancias estupefacientes, psicotrópicos o precursores o de los productos que las contienen.
El cierre temporal de un establecimiento farmacéutico tendrá un plazo máximo de doce (12) meses, contados a partir de la fecha de inicio señalada en la comunicación dirigida a la Autoridad de Salud competente.
Transcurridos los doce (12) meses del cierre temporal de un establecimiento farmacéutico, sin que el propietario o representante legal hubiere comunicado el reinicio de sus actividades a la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM), al Órgano Desconcentrado de la Autoridad Nacional de Salud (OD), o a la Autoridad Regional de Salud (ARS) correspondiente a través de la Autoridad de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios de nivel regional (ARM), la Autoridad de Salud competente dispondrá el cierre definitivo del establecimiento.
En caso el establecimiento cuente con existencias de productos durante el cierre temporal, debe asegurarse el cumplimiento de las Buenas Prácticas de Almacenamiento, bajo responsabilidad del Director Técnico y del propietario o representante legal.
Si la Autoridad, en el ejercicio de sus atribuciones, verifica que un establecimiento farmacéutico ha dejado de funcionar en el lugar autorizado y este cambio no ha sido informado, la Autoridad de Salud competente puede disponer el cierre definitivo del establecimiento.
Artículo 24.- Del reinicio de actividades de los establecimientos farmacéuticos
El reinicio de actividades de cierre temporal debe ser comunicado a la Autoridad de Salud competente. En los casos de cierre temporal que sea hasta por un periodo de un (01) mes, no es necesario comunicar el reinicio de actividades.
Artículo 27.- Subasta de productos o dispositivos provenientes de acciones judiciales o cobranzas coactivas
Toda subasta de productos farmacéuticos, dispositivos médicos y productos sanitarios por razones judiciales o cobranzas coactivas debe ser comunicada, según corresponda, a la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM), el Órgano Desconcentrado de la Autoridad Nacional de Salud (OD), o la Autoridad Regional de Salud (ARS) correspondiente a través de la Autoridad de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios de nivel regional (ARM), con una anticipación de treinta (30) días calendario, previo a su fecha de realización, debiendo el interesado declarar la relación de los productos a subastar.
Los productos o dispositivos que se subasten deben tener registro sanitario, certificado de registro sanitario o notificación sanitaria obligatoria vigente, y sólo pueden ser adjudicados a quienes acrediten ser propietarios o representantes legales de establecimientos farmacéuticos con Autorización Sanitaria de Funcionamiento vigente, siguiendo las normas de abastecimiento para cada tipo de establecimiento.
La Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM), el Órgano Desconcentrado de la Autoridad Nacional de Salud (OD), o la Autoridad Regional de Salud (ARS) correspondiente a través de la Autoridad de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios de nivel regional (ARM), verifica que la subasta de productos o dispositivos cumpla con lo dispuesto en el presente artículo.
Artículo 38.- Libros oficiales o registros electrónicos
Las farmacias y boticas deben contar con libros oficiales:
a) De recetas, cuando realicen preparados farmacéuticos;
b) De control de estupefacientes, cuando corresponda;
c) De control de psicotrópicos, cuando corresponda; y
d) De ocurrencias.
Pueden contar con registro electrónico de datos en un sistema computarizado calificado para el control de estupefacientes y control de psicotrópicos. Así como, un registro computarizado de recetas de los preparados farmacéuticos.
Estos libros o registros electrónicos de datos deben mantenerse actualizados y estar a disposición de los inspectores. En el caso de libros, cada uno de los folios de los libros de control de estupefacientes y psicotrópicos debe estar visado por el Órgano Desconcentrado de la Autoridad Nacional de Salud (OD) o la Autoridad Regional de Salud (ARS) a través de la Autoridad de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios de nivel regional (ARM).
Las recetas de los preparados farmacéuticos deben ser copiadas en orden correlativo y cronológico en forma manual en el libro de recetas o registro computarizado; y en el de ocurrencias se anotarán las rotaciones del personal profesional Químico-Farmacéutico que labora en el establecimiento, la ausencia del Director Técnico debidamente justificada, el nombre del profesional Químico-Farmacéutico asistente que reemplaza al Director Técnico en su ausencia, las notificaciones de sospechas de reacciones adversas e incidentes adversos, así como cualquier otra observación relativa al funcionamiento del establecimiento que el Director Técnico estime relevante.
En los libros de control de estupefacientes y control de psicotrópicos o registro electrónico de datos en un sistema computarizado calificado, se efectuarán las anotaciones que, para cada caso, señalan las disposiciones correspondientes del Reglamento respectivo.
El Director Técnico de la farmacia o botica que cuente con libros de estupefacientes y/o control de psicotrópicos, debe tramitar, ante la Autoridad de Salud correspondiente, la visación respectiva; para ello, debe presentar una solicitud con carácter de declaración jurada, el libro foliado para el control de estupefacientes y/o control de psicotrópicos, y el libro anterior, cuando corresponda.
Se considera un servicio prestado en exclusividad la visación de los libros de control de estupefacientes y/o psicotrópicos. El servicio está sujeto a pago por derecho de trámite.
Artículo 71.- Almacenes y encargo de servicios
Los almacenes de las droguerías no pueden funcionar en mercados de abasto, ferias, campos feriales, galerías comerciales, en predios destinados a casa habitación, clínicas ni consultorios de profesionales de la salud.
Las droguerías pueden encargar el servicio de almacenamiento y/o distribución, a droguerías, almacenes especializados o laboratorios, debiendo asegurarse que cuenten con la Autorización Sanitaria de Funcionamiento correspondiente.
El servicio de almacenamiento que las droguerías brinden puede ser en la modalidad de áreas exclusivas o compartidas. En ninguno de los casos, la droguería, laboratorio o almacén especializado que encarga el servicio pierde la responsabilidad del cumplimiento de las Buenas Prácticas de Almacenamiento. En el caso de áreas compartidas el no cumplimiento de las Buenas Prácticas de Almacenamiento tiene alcance a todas las droguerías, laboratorios o almacenes especializados con quienes comparte el área.
La Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM) o la Autoridad Regional de Salud (ARS) correspondiente, a través de la Autoridad de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios de nivel regional (ARM), puede coordinar o encargar la realización de la inspección o auditoria de aquellas áreas que almacenan productos o dispositivos de droguerías bajo su competencia pero que se encuentran ubicados en un ámbito distinto a su jurisdicción. Esta disposición rige únicamente para las droguerías de Lima Metropolitana y para las droguerías ubicadas en el ámbito territorial de los Gobiernos Regionales de Lima y Callao. En caso de las droguerías ubicadas en las demás regiones, éstas deben tener todas sus áreas dentro del mismo ámbito jurisdiccional.
Las droguerías que encarguen el servicio de almacenamiento deben solicitar autorización sanitaria a la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM), en el ámbito de Lima Metropolitana, o a la Autoridad Regional de Salud (ARS) correspondiente, a través de la Autoridad de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios de nivel regional (ARM), para que ésta verifique previamente el cumplimiento de las Buenas Prácticas de Almacenamiento.
Las droguerías pueden encargar a laboratorios de productos farmacéuticos, dispositivos médicos o productos sanitarios los servicios de fabricación en sus diversas etapas, fraccionamiento, envasado, acondicionado o reacondicionado de estos productos o dispositivos, los mismos que deben contar con certificación de Buenas Prácticas de Manufactura o documento equivalente emitido por la Autoridad o Entidad competente, según corresponda.
Las droguerías que encarguen los servicios de fabricación, envasado, fraccionamiento, acondicionado o reacondicionado deben comunicar a la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM), en el ámbito de Lima Metropolitana, o a la Autoridad Regional de Salud (ARS) correspondiente, a través de la Autoridad de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios de nivel regional (ARM).
Para el encargo de servicios de almacenamiento de productos farmacéuticos, dispositivos médicos o productos sanitarios a otras droguerías o laboratorios, según corresponda, se solicita autorización sanitaria; para lo cual se presentan los siguientes documentos:
a) Solicitud con carácter de declaración jurada;
b) Copia del contrato entre las partes relacionado al servicio a brindar, de acuerdo a lo establecido en las Buenas Prácticas de Almacenamiento;
c) Croquis de distribución interna del almacén considerando las áreas exclusivas o compartidas, incluyendo las climatizadas y refrigeradas, indicando el volumen máximo de almacenamiento en metros cúbicos, en formato A-3.
Para el encargo o ampliación de servicios de fabricación, fraccionamiento, envasado o acondicionado de productos farmacéuticos, dispositivos médicos o productos sanitarios a laboratorios nacionales o extranjeros o reacondicionado a laboratorios nacionales, previamente se debe comunicar a la Autoridad de Salud competente, señalando la relación de productos farmacéuticos consignando el nombre del producto, la Denominación Común Internacional (DCI), concentración y forma farmacéutica a fabricar, o la relación de dispositivos médicos o productos sanitarios, indicando el nombre del producto o dispositivo y su clasificación; y además señalar que cuenta con un contrato escrito entre las partes relacionado al servicio a brindar, de acuerdo a lo establecido en las Buenas Prácticas de Manufactura.
Asimismo, consignar en la comunicación el número de certificado de Buenas Prácticas de Manufactura del fabricante emitido por la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM) o adjuntar copia simple del certificado de Buenas Prácticas de Manufactura de los países de alta vigilancia sanitaria o de los países con los cuales exista reconocimiento mutuo, o documento equivalente a los certificados de acuerdo al tipo de producto o dispositivo emitido por la Autoridad o Entidad competente. Se exceptúa de esta información a los laboratorios de productos sanitarios.
En los almacenes habrá ambientes que garanticen la conservación de las sustancias, productos o dispositivos de acuerdo con su naturaleza y peligrosidad, debiendo estar separados los que contengan sustancias peligrosas, inflamables, explosivas o que requieran condiciones especiales de almacenamiento.
La droguería que brinda servicios a otras droguerías, almacenes especializados o laboratorios debe comunicar a la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM) o a la Autoridad Regional de Salud (ARS) correspondiente, a través de la Autoridad de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios de nivel regional (ARM), la culminación del contrato del servicio prestado.
Artículo 75.- Libros oficiales
Las droguerías deben contar con los siguientes libros oficiales:
a) De control de estupefacientes, cuando corresponda;
b) De control de psicotrópicos, cuando corresponda; y,
c) De ocurrencias.
Las droguerías pueden contar con registro electrónico de datos en un sistema computarizado calificado para el control de estupefacientes y control de psicotrópicos.
Estos libros o registros electrónicos de datos deben mantenerse actualizados y estar a disposición de los inspectores. En caso de contar con libros en físico, cada uno de los folios de los libros de control de estupefacientes y control de psicotrópicos debe estar visado por la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM), en el ámbito de Lima Metropolitana, o por la Autoridad Regional de Salud (ARS) correspondiente a través de la Autoridad de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios de nivel regional (ARM).
El Director Técnico de la droguería que cuente con libros de estupefacientes y/o control de psicotrópicos, debe tramitar, ante la Autoridad de Salud correspondiente, la visación respectiva; para ello, debe presentar una solicitud con carácter de declaración jurada, el libro foliado para el control de estupefacientes y/o control de psicotrópicos, y el libro anterior, cuando corresponda.
Se considera un servicio prestado en exclusividad la visación de los libros de control de estupefacientes y/o psicotrópicos. El servicio está sujeto a pago por derecho de trámite.
El registro de las existencias de precursores de uso médico y otras sustancias sujetas a fiscalización sanitaria, así como la contabilidad relativa a su consumo, se efectúa en el libro o registro electrónicos de datos para el control de psicotrópicos.
En el libro de ocurrencias se anotan las rotaciones del personal profesional Químico-Farmacéutico que labora en el establecimiento, la ausencia del Director Técnico y el nombre del profesional Químico-Farmacéutico asistente que reemplaza al Director Técnico en su ausencia y, otras observaciones que el Director Técnico estime relevante.
Artículo 95.- Libros oficiales
Los Laboratorios de productos farmacéuticos deben contar con los siguientes libros oficiales físicos o electrónicos:
a) De control de estupefacientes, cuando corresponda;
b) De control de psicotrópicos, cuando corresponda.
Los laboratorios pueden contar con registro electrónico de datos en un sistema computarizado calificado para el control de estupefacientes y control de psicotrópicos.
Estos libros o registros electrónicos de datos deben mantenerse actualizados y estar a disposición de los inspectores. En caso de los libros en físico, cada uno de los folios de los libros de control de estupefacientes y control de psicotrópicos debe estar visado por la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM).
El Director Técnico del laboratorio que cuente con libros de estupefacientes y/o control de psicotrópicos, debe tramitar, ante la Autoridad de Salud correspondiente, la visación respectiva; para ello, debe presentar una solicitud con carácter de declaración jurada, el libro foliado para el control de estupefacientes y/o control de psicotrópicos, y el libro anterior, cuando corresponda.
Se considera un servicio prestado en exclusividad la visación de los libros de control de estupefacientes y/o psicotrópicos. El servicio está sujeto a pago por derecho de trámite.
El registro de las existencias de precursores de uso médico y otras sustancias sujetas a fiscalización sanitaria, así como la contabilidad relativa a su consumo, se efectúa en el libro o registro electrónicos de datos para el control de psicotrópicos.
Artículo 109.- Elaboración de productos por encargo
Los laboratorios pueden encargar a otros laboratorios, previa comunicación a la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM) la fabricación de productos o dispositivos, sea en su totalidad o en algunas etapas del proceso de manufactura. La responsabilidad por la calidad del producto o dispositivo es asumida solidariamente por el titular del registro sanitario y el laboratorio fabricante. Las condiciones técnicas del contrato se ajustan a lo previsto en las Buenas Prácticas de Manufactura y Buenas Prácticas de Laboratorio.
Para el encargo o ampliación de servicios de fabricación, envasado, acondicionado, reacondicionado, de productos farmacéuticos, dispositivos médicos o productos sanitarios, previamente se debe comunicar a la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM) señalando la relación de productos farmacéuticos consignando el nombre del producto, la Denominación Común Internacional (DCI), concentración y forma farmacéutica a fabricar, o la relación de dispositivos médicos o productos sanitarios, indicando el nombre del producto o dispositivo y su clasificación; y además señalar que cuenta con un contrato escrito entre las partes relacionado al servicio a brindar, de acuerdo a lo establecido en las Buenas Prácticas de Manufactura.
Asimismo, consignar en la comunicación el número de certificado de Buenas Prácticas de Manufactura del fabricante emitido por la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM) o adjuntar copia simple del certificado de Buenas Prácticas de Manufactura de los países de alta vigilancia sanitaria o de los países con los cuales exista reconocimiento mutuo, o documento equivalente a los certificados de acuerdo al tipo de producto o dispositivo emitido por la Autoridad o Entidad competente. Se exceptúa de esta información a los laboratorios de productos sanitarios.
El servicio de almacenamiento que el laboratorio brinde puede ser en la modalidad de áreas exclusivas o compartidas. En ninguno de los casos, la droguería, el laboratorio o almacén especializado que encarga el servicio pierde la responsabilidad del cumplimiento de las Buenas Prácticas de Almacenamiento. En el caso de áreas compartidas, el no cumplimiento de las Buenas Prácticas de Almacenamiento tiene alcance a todas las droguerías, laboratorios o almacenes especializados con quienes comparte el área.
Los laboratorios que brinden a otras droguerías o laboratorios el servicio de control de calidad de productos o dispositivos terminados deben contar con la certificación de Buenas Prácticas de Laboratorio otorgado por la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM).
El laboratorio que brinda servicio a terceros debe comunicar a la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM) o a la Autoridad Regional de Salud (ARS) correspondiente, a través de la Autoridad de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios de nivel regional (ARM), la culminación del contrato del servicio prestado.
Artículo 116.- Requisitos para la Certificación o renovación de certificación de Buenas Prácticas de Manufactura y Certificación de Buenas Prácticas de Laboratorio en laboratorios nacionales y extranjeros
Para la Certificación o renovación de certificación de Buenas Prácticas de Manufactura y/o Buenas Prácticas de Laboratorio, los interesados deben presentar:
a) Solicitud con carácter de declaración jurada;
b) Papeleta de depósito en cuenta corriente del Ministerio de Salud en el Banco de la Nación por concepto de pasajes y viáticos, cuando se trate de certificaciones a realizarse en el extranjero.
Artículo 125.- Requisitos para la Certificación o renovación de certificación de Buenas Prácticas de Farmacovigilancia
Para la certificación o renovación de certificación de Buenas Prácticas de Farmacovigilancia, se presenta la solicitud con carácter de declaración jurada.
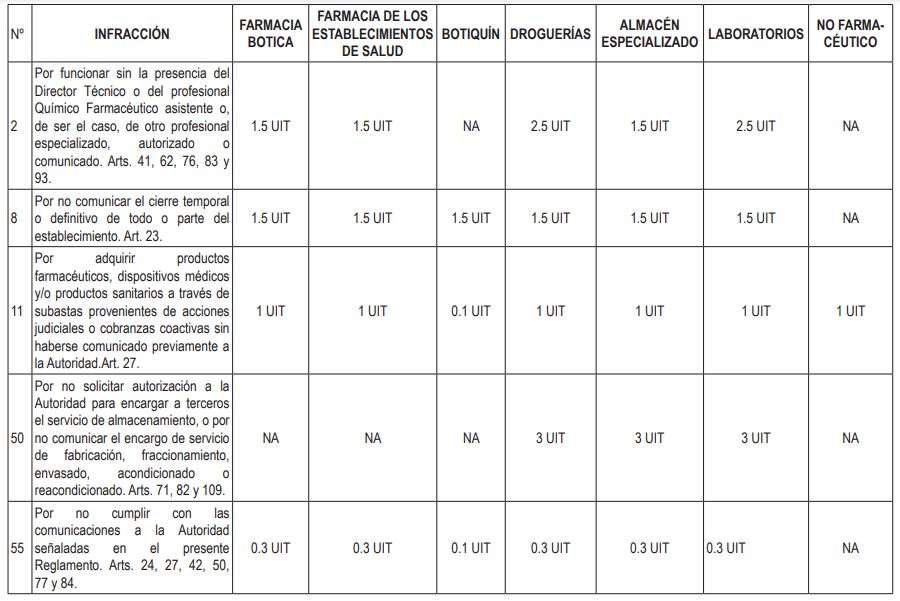
Artículo 2.- Modificación del Anexo 01 del Reglamento de Establecimientos Farmacéuticos
Modifíquense las infracciones 2, 8, 11, 50 y 55 del Anexo 01: Escala por infracciones y sanciones a los establecimientos farmacéuticos y no farmacéuticos del Reglamento de Establecimientos Farmacéuticos, aprobado por Decreto Supremo Nº 014-2011-SA, en los términos siguientes:
Artículo 3.- Refrendo
El presente Decreto Supremo es refrendado por el Ministro de Economía y Finanzas y la Ministra de Salud.
DISPOSICIÓN COMPLEMENTARIA FINAL
Única.- De las comunicaciones
Las comunicaciones señaladas en el presente Decreto Supremo no requieren que la Autoridad correspondiente emita pronunciamiento.
DISPOSICIÓN COMPLEMENTARIA TRANSITORIA
Única.- Regulación transitoria
a) Los procedimientos administrativos iniciados antes de la entrada en vigencia del presente Decreto Supremo, se regirán por la normativa anterior hasta su conclusión.
b) No obstante, son aplicables a los procedimientos en trámite, las disposiciones del presente Decreto Supremo que reconozcan derechos o facultades a los administrados frente a la administración.
Dado en la Casa de Gobierno, en Lima, a los nueve días del mes de enero del año dos mil veintiuno.
FRANCISCO RAFAEL SAGASTI HOCHHAUSLER
Presidente de la República
WALDO MENDOZA BELLIDO
Ministro de Economía y Finanzas
PILAR E. MAZZETTI SOLER
Ministra de Salud

![Juez supremo que intervino como magistrado en la resolución de incidencias (pedido de prisión preventiva y cese) no quebranta la garantía de ser juzgado por un juez imparcial, dado que no emitió un pronunciamiento sobre la responsabilidad penal [Apelación 266-2023, Corte Suprema, f. j. 30]](https://img.lpderecho.pe/wp-content/uploads/2025/07/JUEZ-BALANZA-MAZO-CUADERNO-LPDERECHO-218x150.jpg)
![Tráfico de influencias: No tiene como componente típico «el acuerdo entre las partes», sino la «invocación de influencias y el ofrecimiento de interceder» [Apelación 266-2023, Corte Suprema, f. j. 9]](https://img.lpderecho.pe/wp-content/uploads/2025/07/JUEZA-MAZO-LPDERECHO-218x150.jpg)

![Las comisiones investigadoras deben respetar el derecho a la comunicación previa y detallada de la acusación para solicitar el levantamiento del secreto bancario, además, motivar la necesidad, indispensabilidad y pertinencia para dicho levantamiento [Exp. 00156-2012-HC/TC, f. j. 74]](https://img.lpderecho.pe/wp-content/uploads/2023/01/Logo-LP-con-fondo-guinda-LPDERECHO-218x150.png)
![Diferencia entre «caducidad por cumplimiento del plazo de prisión preventiva» y «cese por revocatoria»: En la primera, para que opere, es indispensable que se encuentre en ejecución hasta su agotamiento; en el segundo, se requiere el aporte ineludible de nuevos elementos materiales [Apelación 150-2024, Corte Suprema f. j. 11]](https://img.lpderecho.pe/wp-content/uploads/2024/04/mazo-abogado-juez-civil-corte-sentencia-juicio-LPDerecho-218x150.jpg)
![Ley Orgánica del Registro Nacional de Identificación y Estado Civil (Ley 26497) [actualizada 2025]](https://img.lpderecho.pe/wp-content/uploads/2025/05/Ley-organica-del-registro-nacional-de-identificacion-y-estado-civil1-LPDERECHO-218x150.jpg)











![¿Quién es el hijo alimentista? [ACTUALIZADO 2025] El hijo alimentista en el Código Civil peruano](https://img.lpderecho.pe/wp-content/uploads/2021/05/El-hijo-alimentista-en-el-Codigo-Civil-peruano-LP-218x150.png)
![¿Cuáles son las clases de testamento según el Código Civil? [ACTUALIZADO 2025] Clases de testamentos en el Código Civil](https://img.lpderecho.pe/wp-content/uploads/2021/04/Clases-de-testamentos-en-el-Codigo-Civil-LP-218x150.png)

![Patrimonio familiar: ¿cómo proteger mi vivienda de un embargo? [ACTUALIZADO 2025]](https://img.lpderecho.pe/wp-content/uploads/2020/12/El-patrimonio-familiar-en-el-Codigo-Civil-peruano-LP-218x150.jpg)



![Sunafil puede sancionar la desnaturalización de contratos incluso si ya terminó el vínculo laboral [Resolución 0484-2025-Sunafil/TFL-Primera Sala]](https://img.lpderecho.pe/wp-content/uploads/2024/03/sunafil-fachada-LPDerecho-218x150.jpg)


![Martín Vizcarra: TC declara infundada demanda de amparo contra su inhabilitación política [Expediente 01716-2024-PA/TC]](https://img.lpderecho.pe/wp-content/uploads/2025/06/VIZCARRA-TC-LPDERECHO-218x150.jpg)


![Indecopi multa a inmobiliaria por no entregar inmueble comprado en preventa [Resolución Final 041-2025/Indecopi-JUN]](https://img.lpderecho.pe/wp-content/uploads/2025/02/indecopi-fachadas-LPDerecho-218x150.jpg)
![Reglamento de la Ley 30364 (Decreto Supremo 009-2016-MIMP) [actualizado 2025]](https://img.lpderecho.pe/wp-content/uploads/2024/07/Reglamento-de-la-Ley-30364-LPDERECHO-218x150.jpg)

![Código Procesal Penal peruano [actualizado 2025]](https://img.lpderecho.pe/wp-content/uploads/2024/02/VENTA-CODIGO-PENAL-BANNER-POST-TAPA-DURA-LPDERECHO-218x150.jpg)
![Reglamento sobre encuestas electorales durante los procesos electorales [Resolución 0107-2025-JNE]](https://img.lpderecho.pe/wp-content/uploads/2025/05/REGLAMENTO-ENCUESTAS-ELECTORALES-LPDERECHO-1-218x150.jpg)
![Diseño de la cédula de sufragio para la Consulta Popular de Revocatoria del Mandato de Autoridades Municipales 2025 [Resolución Jefatural 000031-2025-JN/ONPE]](https://img.lpderecho.pe/wp-content/uploads/2025/05/DISENO-CELULA-SUFRAGIO-REVOCATORIA-LPDERECHO-218x150.jpg)





![[VIDEO] Juez propone que todos los delitos se tramiten en unidades de flagrancia, sin excepción](https://img.lpderecho.pe/wp-content/uploads/2025/05/DELITOS-PLANTEA-TABOA-LPDERECHO-218x150.jpg)
![[VIDEO] Hay jueces que rechazan cautelares porque «el caso es complejo», advierte Giovanni Priori en LP](https://img.lpderecho.pe/wp-content/uploads/2025/05/JUECES-RECHAZAN-CAUTELARES-GIOVANNI-LPDERECHO-218x150.jpg)
![[VIDEO] Pedro Castillo podría buscar asilo político si enfrenta el juicio en libertad, advierten Benji Espinoza y Elio Riera](https://img.lpderecho.pe/wp-content/uploads/2025/05/PEDRO-CASTILLO-ASILO-ABOGADOS-LPDERECHO-218x150.jpg)





![Modifican el TUO del Reglamento general de los registros públicos [Resolución 00090-2025-Sunarp/SN]](https://img.lpderecho.pe/wp-content/uploads/2023/01/que-debe-saber-una-comunidad-campesina-para-poder-renovar-su-directiva-comunal-en-la-sunarp-LPDerecho-218x150.png)


![Código Penal peruano [actualizado 2025]](https://img.lpderecho.pe/wp-content/uploads/2024/05/VENTA-CODIGO-PENAL-LPDERECHO-100x70.jpg)
![Destituyen a juez de paz que emitió un acta de constatación de posesión de un terreno a favor de su cuñada [Investigación Definitiva 10-2023-Sullana]](https://img.lpderecho.pe/wp-content/uploads/2024/11/Portada-web-juez-resolucion-ocultar-100x70.jpg)
![Destituyen a jueza de paz por resolver un proceso de tenencia de menores e intervenir en transferencias de propiedad y posesión [Investigación Definitiva 153-2021-Cusco]](https://img.lpderecho.pe/wp-content/uploads/2024/12/Portada-web-jueza-prueba-grafotecnica-lp-derecho-100x70.jpg)
![Código Procesal Penal peruano [actualizado 2025]](https://img.lpderecho.pe/wp-content/uploads/2024/02/VENTA-CODIGO-PENAL-BANNER-POST-TAPA-DURA-LPDERECHO-100x70.jpg)

![¿Quién es el hijo alimentista? [ACTUALIZADO 2025] El hijo alimentista en el Código Civil peruano](https://img.lpderecho.pe/wp-content/uploads/2021/05/El-hijo-alimentista-en-el-Codigo-Civil-peruano-LP-100x70.png)
![¿Cuáles son las clases de testamento según el Código Civil? [ACTUALIZADO 2025] Clases de testamentos en el Código Civil](https://img.lpderecho.pe/wp-content/uploads/2021/04/Clases-de-testamentos-en-el-Codigo-Civil-LP-100x70.png)

![Patrimonio familiar: ¿cómo proteger mi vivienda de un embargo? [ACTUALIZADO 2025]](https://img.lpderecho.pe/wp-content/uploads/2020/12/El-patrimonio-familiar-en-el-Codigo-Civil-peruano-LP-100x70.jpg)






![[VÍDEO] Elaboración de recurso administrativo de revisión](https://img.lpderecho.pe/wp-content/uploads/2023/04/jose-maria-pacori-cari-LPDerecho-324x160.jpg)