A través del Decreto Supremo 004-2023-SA, aprueban el Reglamento que regula el uso medicinal y terapéutico del cannabis y sus derivados.
DECRETO SUPREMO QUE APRUEBA EL REGLAMENTO QUE REGULA EL USO MEDICINAL Y TERAPÉUTICO DEL CANNABIS Y SUS DERIVADOS
DECRETO SUPREMO Nº 004-2023-SA
LA PRESIDENTA DE LA REPÚBLICA
CONSIDERANDO:
Que, los numerales I y II del Título Preliminar de la Ley Nº 26842, Ley General de Salud, señalan que la salud es condición indispensable del desarrollo humano y medio fundamental para alcanzar el bienestar individual y colectivo; por lo que la protección de la salud es de interés público, siendo responsabilidad del Estado regularla, vigilarla y promoverla;
Que, los numerales 6) y 9) del artículo 3 del Decreto Legislativo Nº 1161, Decreto Legislativo que aprueba la Ley de Organización y Funciones del Ministerio de Salud, establecen que el Ministerio de Salud es competente en productos farmacéuticos y sanitarios, dispositivos médicos y establecimientos farmacéuticos, así como en investigación y tecnologías en salud, y su artículo 4 dispone que el Sector Salud está conformado por el Ministerio de Salud, como organismo rector, las entidades adscritas a él y aquellas instituciones públicas y privadas de nivel nacional, regional y local, y personas naturales que realizan actividades vinculadas a las competencias establecidas en dicha Ley, y que tienen impacto directo o indirecto en la salud, individual o colectiva;
Que, los literales b) y h) del artículo 5 del acotado Decreto Legislativo Nº 1161, Decreto Legislativo que aprueba la Ley de Organización y Funciones del Ministerio de Salud, señalan que son funciones rectoras del Ministerio de Salud, formular, planear, dirigir, coordinar, ejecutar, supervisar y evaluar la política nacional y sectorial de promoción de la salud, vigilancia, prevención y control de las enfermedades, recuperación, rehabilitación en salud, tecnologías en salud y buenas prácticas en salud, bajo su competencia, aplicable a todos los niveles de gobierno; así como dictar normas y lineamientos técnicos para la adecuada ejecución y supervisión de la política nacional y políticas sectoriales de salud, entre otros;
Que, la Ley Nº 30681, Ley que regula el uso medicinal y terapéutico del Cannabis y sus derivados, tiene como finalidad garantizar el derecho fundamental a la salud y permitir el acceso, exclusivamente para uso medicinal y terapéutico, del cannabis y sus derivados. Asimismo, aborda disposiciones sobre el uso informado, la investigación, la producción, la importación y la comercialización del cannabis y sus derivados destinados exclusivamente para fines medicinales y terapéuticos;
Que, con Decreto Supremo Nº 005-2019-SA se aprueba el Reglamento de la Ley Nº 30681, Ley que regula el uso medicinal y terapéutico del Cannabis y sus derivados;
Que, el artículo 3-A de la Ley Nº 30681, incorporado por la Ley Nº 31312, Ley que incorpora y modifica artículos de la Ley Nº 30681, Ley que regula el uso medicinal y terapéutico del cannabis y sus derivados; define la producción artesanal con cultivo asociativo como el cultivo de cannabis y su procesamiento para obtener cannabis medicinal que realizan las asociaciones formadas únicamente por pacientes inscritos en el Registro de pacientes usuarios del cannabis y sus derivados para uso medicinal y terapéutico, o sus apoyos designados o representantes legales, para exclusivo beneficio de los pacientes calificados que las integran; y, el artículo 8-A de la referida Ley Nº 30681, establece los aspectos referidos a la licencia para la producción artesanal con cultivo asociativo, por el que se autoriza el cultivo, procesamiento, transporte y almacenamiento de cannabis y sus derivados para fines medicinales y terapéuticos exclusivamente, para los titulares de la licencia o los indicados en ella, conforme a los requisitos establecidos por el Ministerio de Salud;
Que, la Segunda Disposición Complementaria Final de la Ley Nº 31312 señala que el Poder Ejecutivo adecúa la normativa a su cargo a fin de armonizarla con sus disposiciones;
Que, de conformidad con el Decreto Ley Nº 25909, concordante con el artículo 4 del Decreto Ley Nº 25629, ninguna entidad, con excepción del Ministerio de Economía y Finanzas, puede irrogarse la facultad de dictar medidas destinadas a restringir o impedir el libre fl ujo de mercancías mediante la imposición de trámites requisitos o medidas de cualquier naturaleza que afecten las importaciones o exportaciones y que, por ende, son nulos todos los actos que contravengan esta disposición, debiendo aprobarse dichas disposiciones únicamente mediante Decreto Supremo refrendado por el Ministerio de Economía y Finanzas y por el Sector involucrado;
Que, en consecuencia, resulta necesario aprobar el Reglamento que regula el uso medicinal y terapéutico del cannabis y sus derivados, conforme a las disposiciones establecidas en la Ley Nº 30681, Ley que regula el uso medicinal y terapéutico del Cannabis y sus derivados, y la Ley Nº 31312 que la modifica, con el objeto de garantizar el uso medicinal y terapéutico del cannabis y sus derivados, derogándose el artículo 1 del Decreto Supremo Nº 005-2019-SA, Decreto Supremo que aprueba el Reglamento de la Ley Nº 30681, Ley que regula el uso medicinal y terapéutico del Cannabis y sus derivados;
De conformidad con lo establecido en el numeral 8 del artículo 118 de la Constitución Política del Perú; el Decreto Ley Nº 25629, que restablece la vigencia del artículo 19 del Decreto Legislativo Nº 701 y del artículo 44 del Decreto Legislativo Nº 716, derogados por el artículo 2 de la Ley Nº 25399; el Decreto Ley Nº 25909, que dispone que ninguna entidad, con excepción del Ministerio de Economía y Finanzas, puede irrogarse la facultad de dictar medidas destinadas a restringir el libre fl ujo de mercancías tanto en las importaciones como en las exportaciones; y, la Ley Nº 29158, Ley Orgánica del Poder Ejecutivo;
DECRETA:
Artículo 1.- Aprobación
Aprobar el Reglamento que regula el uso medicinal y terapéutico del cannabis y sus derivados, que consta de catorce (14) capítulos, cincuenta (50) artículos, catorce (14) disposiciones complementarias finales, una (1) disposición complementaria transitoria y ocho (8) anexos, que forma parte del presente Decreto Supremo.
Artículo 2.- Financiamiento
La implementación de lo dispuesto en la presente norma se financia con cargo al presupuesto institucional de los pliegos involucrados, sin demandar recursos adicionales al Tesoro Público.
Artículo 3.- Publicación
El presente Decreto Supremo y el Reglamento aprobado, se publican en la Plataforma Digital Única del Estado Peruano para Orientación al Ciudadano (www.gob.pe), así como en la sede digital de la Presidencia del Consejo de Ministros (www.gob.pe/pcm) del Ministerio de Salud (www.gob.pe/minsa), del Ministerio de Desarrollo Agrario y Riego (www.gob.pe/midagri), del Ministerio de Economía y Finanzas (www.gob.pe/mef), del Ministerio del Interior (www.gob.pe/mininter) y del Ministerio de Comercio Exterior y Turismo (www.gob.pe/mincetur), el mismo día de su publicación en el Diario Oficial El Peruano.
Artículo 4.- Refrendo
El presente Decreto Supremo es refrendado por el Presidente del Consejo de Ministros, la Ministra de Desarrollo Agrario y Riego, el Ministro de Economía y Finanzas, el Ministro del Interior, la Ministra de Salud y el Ministro de Comercio Exterior y Turismo.
DISPOSICIONES COMPLEMENTARIAS FINALES
Primera.- Exportación de cannabis y sus derivados
La exportación de cannabis y sus derivados para uso medicinal y terapéutico y la obtención del Certificado Oficial de Exportación se rigen conforme a las disposiciones del Decreto Ley Nº 22095, Ley de represión del tráfico ilícito de drogas y del Reglamento de estupefacientes, psicotrópicos y otras sustancias sujetas a fiscalización sanitaria, aprobado por Decreto Supremo Nº 023-2001-SA, y sus modificatorias.
Segunda.- Vigencia
El presente Decreto Supremo entra en vigencia en un plazo de seis (6) meses, contados a partir del día siguiente de su publicación en el Diario Oficial El Peruano.
DISPOSICIÓN COMPLEMENTARIA DEROGATORIA
ÚNICA.- Derogación
Derogar el artículo 1 del Decreto Supremo Nº 005-2019-SA que aprueba el Reglamento de la Ley Nº 30681, Ley que regula el uso medicinal y terapéutico del cannabis y sus derivados.
Dado en la Casa de Gobierno, en Lima a los veintisiete días del mes de febrero del año dos mil veintitrés.
DINA ERCILIA BOLUARTE ZEGARRA
Presidenta de la República
LUIS ALBERTO OTÁROLA PEÑARANDA
Presidente del Consejo de Ministros
LUIS FERNANDO HELGUERO GONZÁLEZ
Ministro de Comercio Exterior y Turismo
NELLY PAREDES DEL CASTILLO
Ministra de Desarrollo Agrario y Riego
ALEX ALONSO CONTRERAS MIRANDA
Ministro de Economía y Finanzas
VICENTE ROMERO FERNÁNDEZ
Ministro del Interior
ROSA BERTHA GUTIÉRREZ PALOMINO
Ministra de Salud
REGLAMENTO QUE REGULA EL USO MEDICINAL Y TERAPÉUTICO DEL CANNABIS Y SUS DERIVADOS
CAPÍTULO I
DISPOSICIONES GENERALES
Artículo 1.- Objeto
1.1. El presente Reglamento regula las disposiciones establecidas en la Ley Nº 30681, Ley que regula el uso medicinal y terapéutico del Cannabis y sus derivados, y la Ley Nº 31312 que la modifica, con el objeto de garantizar el uso medicinal y terapéutico del cannabis y sus derivados.
1.2. El Estado garantiza el acceso al cannabis y sus derivados exclusivamente para fines medicinales y terapéuticos, promoviendo su uso racional.
Artículo 2.- Definiciones
Para la aplicación del presente Reglamento se señalan las siguientes definiciones:
2.1. Administrados: Para los efectos del presente Reglamento, son personas naturales o jurídicas, los establecimientos farmacéuticos autorizados y certificados en buenas prácticas, universidades, instituciones de investigación agraria y en salud, entidades públicas y asociaciones de pacientes usuarios del cannabis, según corresponda, por la Autoridad competente, para realizar actividades de investigación, producción, importación y comercialización del cannabis y sus derivados, producción artesanal de derivados del cannabis con cultivo asociativo de la planta del género cannabis, destinados exclusivamente con fines medicinales y terapéuticos. También se considera como administrados a lo/as pacientes que hacen uso informado del cannabis y sus derivados para fines medicinales y terapéuticos, o sus familiares, tutores, curadores o apoyos cuando deban obrar por aquellos, para efectos de su tratamiento.
2.2. Asociaciones de pacientes usuarios del cannabis: En el marco del presente Reglamento, éstas son constituidas por dos (02) o más pacientes o representantes legales o sus apoyos designados, inscritos en el Registro de pacientes usuarios del cannabis y sus derivados para uso medicinal y terapéutico, para exclusivo beneficio de los/las pacientes, calificados por el médico tratante, que las integran; asimismo, estas asociaciones se acogen a lo determinado por el Código Civil (Decreto Legislativo Nº 295), las cuales deben estar debidamente acreditadas y certificadas.
2.3. Cancelación de licencia: Acción formal de detener de manera definitiva la autorización para realizar actividades de investigación, producción, importación, comercialización del cannabis y sus derivados, y producción artesanal de derivados del cannabis con cultivo asociativo de la planta del género cannabis.
2.4. Cannabis: Sumidades floridas o con fruto, de la planta de cannabis (a excepción de las semillas y las hojas no unidas a las sumidades) de las cuales no se ha extraído la resina, cualquiera que sea el nombre con que se las designe.
Y se clasifican en:
a. Cannabis psicoactivo: Cuyo contenido de tetrahidrocannabinol (THC) es igual o superior al 1% en peso seco y que son utilizadas para fines medicinales y terapéuticos.
b. Cannabis no psicoactivo: Cuyo contenido de tetrahidrocannabinol (THC) es inferior a 1% en peso seco y que son utilizadas para fines medicinales y terapéuticos.
2.5. Comercialización de productos derivados del cannabis para uso medicinal y terapéutico: Transferencia de propiedad de los productos derivados del cannabis para uso medicinal y terapéutico señalados en el presente Reglamento, siendo aplicables las disposiciones del Reglamento de Estupefacientes, Psicotrópicos y otras Sustancias Sujetas a Fiscalización Sanitaria, y modificatorias. El proceso de transferencia incluye la adquisición, almacenamiento, distribución y transporte y dispensación, conforme al presente Reglamento.
Lo antes señalado no es aplicable para la producción artesanal de derivados del cannabis con cultivo asociativo de la planta del género cannabis, por ser ésta de exclusivo beneficio de lo/as pacientes calificados por el/la médico tratante que integran las asociaciones de pacientes usuarios del cannabis.
2.6. Cultivo de la planta de cannabis para uso medicinal: Es la actividad comprendida desde la obtención de la semilla, siembra, manejo y cosecha de la planta de cannabis (sumidades fl oridas o con fruto) para uso medicinal.
2.7. Derivados de cannabis para uso medicinal y terapéutico: Se refiere a todo compuesto, mezcla o preparación, o producto, derivado del cannabis para uso medicinal y terapéutico, entendiéndose como producto terminado a la especialidad farmacéutica, medicamento herbario, preparado farmacéutico y producto natural de uso en salud, definidos en la presente norma. Además, se considera producto derivado de cannabis para uso medicinal y terapéutico a las preparaciones herbarias: Extractos, tintura y aceites que se producen por extracción, purificación y concentración y que sirven como base a los medicamentos herbarios, productos naturales de uso en salud y preparados farmacéuticos derivados de cannabis para uso medicinal y terapéutico.
2.8. Ensayo clínico: Para efectos del presente Reglamento se define como ensayo clínico a toda investigación que asigna prospectivamente a seres humanos a derivados del cannabis que constituye un producto farmacéutico en la clasificación de especialidad farmacéutica o un medicamento herbario, con el objetivo de evaluar sus efectos sobre la salud. Se incluyen estudios de todas las fases reconocidas internacionalmente: Fase 1, fase 2, fase 3, fase 4.
2.9. Especialidad farmacéutica: Medicamento de síntesis química las cuales son definidas como compuestos de estructura química definida, de bajo peso molecular empleado para la prevención, diagnóstico o tratamiento de una enfermedad o estado patológico o para modificar sistemas fisiológicos en beneficio de la persona a quien le fue administrado y designado con su Denominación Común Internacional (DCI) u otra denominación o nombre comercial.
Incluye a la especialidad farmacéutica multifuentes e innovadores.
2.10. Estudio preclínico: Para los efectos del presente Reglamento, es la fase de la investigación realizada antes de los ensayos clínicos. El objetivo principal es evaluar la seguridad (caracterización de los efectos tóxicos con respecto a los órganos diana, la dependencia de la dosis, la relación con la exposición y, cuando corresponda, la reversibilidad potencial) y la actividad farmacológica del producto de investigación. La fase preclínica incluye: Ensayos en células o tejidos (in vitro), modelos computacionales (in silico), pruebas físico-químicas (in chimico) y/o en organismos vivos (in vivo) con la finalidad de conocer la actividad farmacológica y la toxicología del producto en investigación seleccionado.
Los ensayos que estudian la seguridad del medicamento a nivel preclínico deben realizarse cumpliendo las normas de Buenas Prácticas de Laboratorio (BPL-PC). La evaluación preclínica sirve para informar el diseño del ensayo clínico y el uso previsto en humanos. Antes de proceder a los estudios en humanos, se debe contar con suficiente información no clínica para apoyar las dosis iniciales en humanos y la duración de la exposición. Esta fase suele incluir la toxicología, carcinogenicidad, inmunogenicidad, farmacología, farmacocinética y otras evaluaciones para apoyar los ensayos clínicos. Para la realización de cada estudio, debe tenerse en consideración las guías científicas internacionales de referencia.
Son consignadas exclusivamente a la producción de semillas o plántulas para siembra de cannabis materia del presente Reglamento.
2.12. Importación: Es la actividad de ingreso al territorio nacional de semillas de cannabis, cannabis y sus derivados para uso medicinal y terapéutico.
2.13. Materia prima: Cannabis (sumidades fl oridas o con fruto) para uso medicinal o sus derivados, que contienen y proporcionan los principios activos como metabolitos, llamados cannabinoides (entre ellos el tetrahidrocannabinol o THC y cannabidiol o CBD).
2.14. Medicamento herbario derivado de cannabis para uso medicinal y terapéutico: Producto derivado del cannabis para uso medicinal y terapéutico que constituye un producto medicinal terminado, elaborado a partir de la planta de cannabis para uso medicinal y terapéutico, presentado en forma farmacéutica, el cual posee actividad terapéutica y cuya eficacia, seguridad y calidad han sido demostradas científicamente ante la Autoridad competente.
2.15. Planta de cannabis: Toda planta herbácea anual, dioica de la familia Cannabaceae del género cannabis.
2.16. Preparado farmacéutico derivado de cannabis para uso medicinal y terapéutico: Son preparados bajo fórmulas magistrales, elaborados por el/la profesional Químico Farmacéutico o bajo su dirección en una oficina farmacéutica especializada, farmacia de establecimiento de salud y en las farmacias o boticas, con área de técnica exclusiva y autorizada previamente para la elaboración de estos preparados, según las normas técnicas y científicas del arte farmacéutico.
2.17. Producción artesanal con cultivo asociativo: Procesamiento alternativo para obtener derivado de cannabis para uso medicinal y terapéutico, realizado por las asociaciones formadas únicamente por pacientes inscritos en el Registro de pacientes usuarios del cannabis y sus derivados para uso medicinal y terapéutico, o sus apoyos designados o representantes legales, para exclusivo beneficio de los/las pacientes calificados por el médico tratante que integran dichas asociaciones.
2.18. Producción de derivados de cannabis con cultivo: Procesamiento para obtener derivados de cannabis para fines medicinales y terapéuticos, que consiste en la adquisición de semillas de cannabis, siembra, propagación, cultivo, cosecha, post-cosecha, fabricación, acondicionado y reacondicionado de productos derivados de cannabis, así como actividades de almacenamiento y transporte de semillas, plántulas, plantas, fl ores y productos derivados de cannabis para uso medicinal y terapéutico.
2.19. Producción de derivados de cannabis sin cultivo: Procesamiento para obtener derivados de cannabis para fines medicinales y terapéuticos, que consiste en la fabricación, acondicionado y reacondicionado de productos derivados de cannabis, así como actividades de almacenamiento y transporte de productos derivados de cannabis para uso medicinal y terapéutico.
2.20. Producto farmacéutico derivado del cannabis para uso medicinal y terapéutico: Medicamento herbario o de especialidad farmacéutica que contiene derivado de cannabis para uso medicinal y terapéutico, presentado en forma farmacéutica, y que ha completado todas las etapas de producción, que incluye el envasado y empaque final, el cual posee actividad terapéutica y cuya eficacia, seguridad y calidad han sido demostradas científicamente ante la Autoridad competente.
2.21. Producto natural derivado de cannabis de uso en salud: Producto medicinal y terapéutico elaborado a partir de materia prima, cuya sustancia activa corresponde a alguna de las partes de dicho recurso o resulta de asociaciones, combinaciones o mezclas de recursos en estado natural, y es presentado en formas farmacéuticas. Incluye aceites, tinturas, resinas y extractos, presentados en formas farmacéuticas.
2.22. Receta especial: En el marco del presente Reglamento, es la receta médica utilizada para la prescripción de medicamentos estupefacientes y psicotrópicos, según lo establecido en el Reglamento de Estupefacientes, Psicotrópicos y otras sustancias sujetas a fiscalización sanitaria, y que se rige por las disposiciones de uso, control y fiscalización establecidas en el Reglamento mencionado; estas recetas tienen un sistema de numeración que permite una identificación única. Se expide la receta especial cuando en su formulación el contenido de tetrahidrocannabinol (THC) es igual o superior al 1%.
2.23. Receta médica: En el marco del presente Reglamento, es el documento emitido por el/la Médico Cirujano tratante que incluye la prescripción y que está orientado a solucionar o prevenir un problema de salud en un determinado paciente. La receta médica debe ser elaborada en forma clara y legible y cumplir con los requisitos establecidos en el Reglamento de Establecimientos Farmacéuticos y demás normas vigentes. La receta médica, bajo el formato establecido en el Sistema Integrado de Suministro Público de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios, se denomina Receta Única Estandarizada (RUE). Se expide la receta médica cuando en su formulación el contenido de tetrahidrocannabinol (THC) es inferior al 1% o cuando sólo contenga cannabidiol (CBD).
2.24. Registro Nacional de Pacientes Usuarios del Cannabis y sus derivados para uso medicinal y terapéutico (RENPUC): Tiene como finalidad registrar a los pacientes usuarios del cannabis y sus derivados para uso medicinal y terapéutico, calificados por el/la médico tratante. Este registro incluye obligatoriamente, como mínimo, la información de la enfermedad, del médico tratante, dosis y frecuencia del tratamiento, sus apoyos designados o representantes legales si los tuviere. El contenido de este registro tiene carácter confidencial, acorde a lo dispuesto por la Ley Nº 29733, Ley de protección de datos personales.
2.25. Semilla de cannabis: Toda estructura botánica destinada a la propagación sexual o asexual del género cannabis.
2.26. Suspensión de licencia: Acción formal que detiene de manera temporal la autorización para realizar actividades de investigación, producción, importación, comercialización del cannabis y sus derivados, y producción artesanal de derivados del cannabis con cultivo asociativo de la planta del género cannabis.
Artículo 3.- Ámbito de aplicación
3.1. Las disposiciones contenidas en el presente Reglamento regulan el uso informado del cannabis y sus derivados, y son de aplicación general para los/las usuario/as y administrado/as que realicen actividades de investigación, producción, importación, comercialización del cannabis y sus derivados, y producción artesanal de derivados del cannabis con cultivo asociativo de la planta del género cannabis, destinados exclusivamente con fines medicinales y terapéuticos.
3.2. El presente Reglamento es aplicable al cannabis y sus derivados cuyas partidas arancelarias se encuentran descritas en el Anexo Nº 1.
CAPÍTULO II
AUTORIDADES DE CONTROL
Artículo 4.- Autoridades de control competentes
Las autoridades competentes en el marco de la Ley Nº 30681, Ley que regula el uso medicinal y terapéutico del cannabis y sus derivados, la Ley Nº 31312 que la modifica, y otras normas que otorgan competencias y funciones en esta materia y del presente reglamento, son las siguientes:
4.1. El Ministerio de Salud – MINSA, a través de:
a. La Dirección General de Medicamentos, Insumos y Drogas (DIGEMID) como Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM); y, las Direcciones de Redes Integradas de Salud (DIRIS) o quienes hagan sus veces, como órganos desconcentrados de la Autoridad Nacional de Salud (OD), a través de las Direcciones de Medicamentos, Insumos y Drogas o quienes hagan sus veces, son las autoridades competentes para expedir la licencia para la producción, licencia de importación, comercialización y para la licencia de producción artesanal de derivados del cannabis con cultivo asociativo de la planta del género cannabis, según corresponda; así como de realizar el control y fiscalización sanitaria de los establecimientos farmacéuticos, universidades o instituciones de investigación y asociaciones, así como los productos derivados de cannabis.
La DIGEMID es la Autoridad competente para expedir la licencia para la investigación científica de derivados del cannabis para estudio preclínico sin cultivo; asimismo realiza el control y fiscalización del producto de investigación.
b. El Instituto Nacional de Salud (INS), es la Autoridad competente para expedir la licencia para la investigación científica de derivados del cannabis para ensayo clínico sin cultivo, y para autorizar y regular la realización de ensayos clínicos con los derivados de cannabis; así como de registrar los ensayos clínicos y de diseño observacional en humanos.
4.2. El Ministerio de Desarrollo Agrario y Riego (MIDAGRI), a través de:
a. La Dirección General de Desarrollo Agrícola y Agroecología (DGDAA) o la que haga sus veces, es la Autoridad competente para expedir la autorización del Plan de Producción Agrícola de Cannabis, en el marco de sus competencias según el Reglamento de Organización y Funciones del MIDAGRI; asimismo, emite los informes respecto a los planes de producción agrícola para el otorgamiento de las licencias de producción de cannabis con fines medicinales y terapéuticos que incluye el cultivo, el mismo que debe ser aprobado mediante Resolución Directoral; y, supervisa los planes de producción agrícola aprobados según los lineamientos para la formulación del Plan de Producción Agrícola de cannabis con fines medicinales y terapéuticos para el otorgamiento de la Licencia de Producción que incluye el cultivo, aprobados por Resolución Ministerial.
b. El Instituto Nacional de Innovación Agraria (INIA) es la Autoridad competente para expedir la licencia para la investigación científica, con cultivo de la planta del género cannabis.
c. El Servicio Nacional de Sanidad Agraria (SENASA), en su calidad de autoridad en sanidad vegetal y en semillas, es la instancia de control en los puntos de ingreso al país en lo concerniente al procedimiento de importación de cannabis y semillas de cannabis, y para normar las actividades vinculadas a su competencia.
4.3. El Ministerio del Interior (MININTER), a través de:
La Dirección Antidrogas (DIRANDRO) de la Policía Nacional del Perú (PNP), es la Autoridad competente que certifica el cumplimiento de las medidas de seguridad con el objeto de garantizar la seguridad e intangibilidad física del cannabis y sus derivados, así como del producto terminado, para uso medicinal y terapéutico.
4.4. Los Gobiernos Regionales, a través de:
Las Direcciones Regionales de Salud o las que hagan sus veces a nivel regional como Autoridades Regionales de Salud (ARS), a través de las Direcciones Regionales de Medicamentos, Insumos y Drogas como Autoridades de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios de nivel regional (ARM) o quienes hagan sus veces, son las autoridades competentes para expedir la licencia de importación, comercialización y para la producción artesanal de derivados del cannabis con cultivo asociativo de la planta del género cannabis, según corresponda, así como de realizar el control y fiscalización sanitaria de los establecimientos farmacéuticos y asociaciones de pacientes usuarios de cannabis de su jurisdicción y productos derivados de cannabis.
CAPÍTULO III
LICENCIAS
Artículo 5.- Licencia
5.1. Es el documento oficial que la Autoridad competente otorga a los/las administrado/as a través de un procedimiento de evaluación previa, que les autoriza para realizar las actividades de investigación, producción, importación, comercialización del cannabis y sus derivados, y producción artesanal de derivados del cannabis con cultivo asociativo de la planta del género cannabis, destinados exclusivamente para fines medicinales y terapéuticos.
5.2. La licencia expedida de acuerdo con el presente Reglamento y los derechos que ella otorga no pueden ser objeto de transferencia bajo ningún título.
Artículo 6.- Vigencia, calificación de procedimientos, suspensión y cancelación de las licencias
6.1. El plazo de vigencia de las licencias contempladas en el presente Reglamento, es indeterminado. Las licencias se otorgan en un plazo no mayor a treinta (30) días hábiles, cuya calificación de los procedimientos son de evaluación previa sujetos a silencio administrativo negativo, de acuerdo a lo dispuesto en el artículo 38 del Texto Único Ordenado de la Ley Nº 27444, Ley del Procedimiento Administrativo General, aprobado con Decreto Supremo Nº 004-2019-JUS.
6.2. La suspensión y cancelación de las licencias está a cargo de la entidad otorgante, en aplicación a las causales dispuestas en el presente numeral, sin perjuicio de la aplicación de lo establecido por el Reglamento de Establecimientos Farmacéuticos, aprobado con Decreto Supremo Nº 014-2011-SA y sus modificatorias, así como por el Reglamento para el Registro, Control y Vigilancia Sanitaria de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios, aprobado con Decreto Supremo Nº 016-2011-SA, y sus modificatorias.
6.3. Toda ampliación o modificación de la información declarada para la obtención de una licencia o toda modificación de las actividades para las cuales han sido otorgadas las licencias, a excepción de lo previsto en el numeral 16.1 del artículo 16 del presente Reglamento, deben ser comunicadas previamente por el titular de la licencia a la Autoridad competente.
6.4. Las entidades otorgantes de las licencias implementan en el marco de sus competencias un sistema de alertas o notificaciones sobre las suspensiones, cancelaciones y modificaciones de las licencias emitidas.
CAPÍTULO IV
LICENCIA PARA LA INVESTIGACIÓN CIENTÍFICA, CON O SIN CULTIVO DE LA PLANTA DEL GÉNERO CANNABIS, PARA LAS UNIVERSIDADES E INSTITUCIONES DE INVESTIGACIÓN AGRARIA Y EN SALUD
Artículo 7.- Licencia para la investigación científica, con o sin cultivo de la planta del género cannabis
7.1. La licencia para la investigación científica, con o sin cultivo de la planta del género cannabis, se otorga exclusivamente a las universidades e instituciones que realizan investigación agraria y en salud.
7.2. La licencia para la investigación científica, con o sin cultivo de la planta del género cannabis, puede ser de tres (3) tipos:
a. Licencia para la investigación científica de derivados del cannabis para ensayo clínico sin cultivo, a cargo del Instituto Nacional de Salud – INS.
b. Licencia para la investigación científica de derivados del cannabis para estudio preclínico sin cultivo, a cargo de la Dirección General de Medicamentos Insumos y Drogas – DIGEMID.
c. Licencia para la investigación científica, con cultivo de la planta del género cannabis, a cargo del Instituto Nacional de Innovación Agraria – INIA del Ministerio de Desarrollo Agrario y Riego – MIDAGRI.
7.3. Dada la diversidad de los proyectos de investigación científica, las licencias de investigación científica, con o sin cultivo de la planta del género cannabis, incluyen las actividades que son necesarias para cumplir con los protocolos de investigación, tales como: importación, almacenamiento, cultivo, cosecha, propagación, transporte y fabricación de derivados del cannabis.
7.4. A efecto que la DIGEMID informe internacionalmente la cantidad de los derivados de cannabis empleados en las investigaciones de tipo ensayo clínico o estudio preclínico, sin cultivo, las universidades o instituciones de investigación que cuenten con la licencia correspondiente, deben de presentar a la DIGEMID, un informe que contenga la cantidad de derivado de cannabis utilizada en la investigación, hasta el 31 de enero de cada año. De igual forma, las universidades o instituciones de investigación agraria que realizan investigación científica agraria también deben presentar el mencionado informe a la DIGEMID, en la condición antes establecida. De no presentarse la información señalada en el presente numeral, la DIGEMID comunica este hecho a la DIRANDRO.
Artículo 8.- Licencia para la investigación científica de derivados del cannabis para ensayo clínico sin cultivo
8.1. La licencia para la investigación científica de derivados del cannabis para ensayo clínico sin cultivo, se otorga a universidades o instituciones de investigación que realicen investigación científica en salud con fines medicinales.
La investigación científica en salud con fines medicinales solamente implica que el producto de investigación corresponde a un derivado de cannabis que constituye un producto farmacéutico en la clasificación de especialidad farmacéutica o un medicamento herbario.
8.2. Para otorgar la licencia de investigación se requiere presentar los siguientes requisitos:
a. Solicitud de licencia de investigación, que debe contener la siguiente información:
– Razón social, así como domicilio legal y número de Registro Único de Contribuyente (RUC), número de teléfono y correo electrónico de sus contactos oficiales.
– Nombre del representante legal, con la respectiva acreditación en Registros Públicos.
– Nombre y dirección de los centros de investigación donde se realizan las investigaciones.
– Número de comprobante de pago y fecha de emisión.
– Número de certificado de cumplimiento de dispositivos de seguridad para el desarrollo de actividades con cannabis y sus derivados, regulado para el uso medicinal y terapéutico, emitido por la Dirección Antidrogas de la Policía Nacional del Perú – DIRANDRO de la PNP.
b. Informe técnico que describa y sustente que la universidad o institución de investigación tiene capacidad para realizar proyectos de investigación científica para ensayos clínicos sin cultivo, de acuerdo con las disposiciones que apruebe el INS mediante Resolución Jefatural.
8.3. Contando la universidad o institución de investigación con la licencia de investigación científica de derivados del cannabis para ensayo clínico sin cultivo, las mismas deben gestionar posteriormente la autorización para la realización de un ensayo clínico, según lo dispuesto en el Reglamento de Ensayos Clínicos aprobado por el Decreto Supremo Nº 021-2017-SA, o la norma que haga sus veces.
8.4. Para efectos del presente Reglamento, la investigación científica en salud de derivados del cannabis con seres humanos de diseño observacional se refiere a la investigación realizada exclusivamente de los registros clínicos de pacientes o historias clínicas; estas investigaciones deben contar con la autorización de un comité de ética acreditado en el INS, y registrarse en la base de datos pública administrada por el INS. Las universidades e instituciones de investigación no requieren de una licencia para realizar este tipo de investigaciones.
Artículo 9.- Licencia para la investigación científica de derivados del cannabis para estudio preclínico sin cultivo
9.1. La licencia para la investigación científica de derivados del cannabis para estudio preclínico sin cultivo, permite a la universidad o institución de investigación, realizar estudios preclínicos de derivados de cannabis en investigación científica para uso medicinal o terapéutico.
9.2. La realización de un estudio preclínico de un producto derivado del cannabis, se rige por la NTS Nº 170-MINSA/2020/DIGEMID: Norma Técnica de Salud que regula las Buenas Prácticas de Laboratorio para Estudios Preclínicos (BPL-PC) en la Investigación y Desarrollo de Productos Farmacéuticos, aprobada por Resolución Ministerial Nº 1032-2020/MINSA, o la que haga sus veces.
9.3. Para otorgar la licencia de investigación se requiere presentar los siguientes requisitos:
a. Solicitud de licencia de investigación, que debe contener la siguiente información:
– Razón social, así como domicilio legal y número de Registro Único de Contribuyente (RUC), número de teléfono y correo electrónico de sus contactos oficiales.
– Nombre del representante legal, con la respectiva acreditación en Registros Públicos.
– Nombre y dirección del laboratorio de estudios preclínicos donde se realizará la investigación.
– Número de registro de laboratorio de estudios preclínicos en seguridad.
– Número de comprobante de pago y fecha de emisión.
– Número de certificado de cumplimiento de dispositivos de seguridad para el desarrollo de actividades con cannabis y sus derivados, regulado para el uso medicinal y terapéutico, emitido por la Dirección Antidrogas de la Policía Nacional del Perú – DIRANDRO de la PNP.
b. Copia del documento de aprobación del protocolo de investigación por un Comité de Ética de Investigación.
En caso de investigación con animales, la aprobación la otorga un Comité de Ética de Investigación para uso animal.
9.4. La presente licencia no permite el uso de fauna silvestre para la investigación científica de derivados del cannabis para estudio preclínico sin cultivo, para lo cual se debe cumplir con lo dispuesto por la Ley Nº 29763, Ley Forestal y de Fauna Silvestre, el Reglamento para la Gestión de Fauna Silvestre, aprobado por Decreto Supremo Nº 019-2015-MINAGRI, y la Ley Nº 30407, Ley de Protección y Bienestar Animal.
Artículo 10.- Licencia para la investigación científica con cultivo de la planta del género cannabis
10.1. Es la licencia que se otorga a universidades o instituciones de investigación agraria que realizan investigación científica agraria o con algún componente agrario.
10.2. La investigación debe necesariamente tener como objetivo del protocolo de investigación el estudio del cannabis para uso medicinal y terapéutico en el marco de lo establecido en la Ley Nº 30681, Ley que regula el uso medicinal y terapéutico del Cannabis y sus derivados, y la Ley Nº 31312 que la modifica.
10.3. Para otorgar la licencia se requiere presentar los siguientes requisitos:
a. La solicitud de licencia de investigación, que debe contener:
– Razón social de la universidad o institución de investigación, así como domicilio y número de Registro Único de Contribuyente (RUC).
– Nombres y apellidos del representante legal, número de teléfono y correo electrónico.
– Nombres y apellidos o razón social del patrocinador, si lo hubiere.
– Nombre y dirección donde se realiza la investigación.
– Nombre del proyecto de investigación.
– Nombre del investigador principal.
– Ubicación georreferenciada del lugar donde se lleva a cabo la investigación.
– Número de comprobante de pago y fecha de emisión.
– Número del certificado de cumplimiento de dispositivos de seguridad para el desarrollo de actividades con cannabis y sus derivados, regulado para el uso medicinal y terapéutico, emitido por la DIRANDRO de la PNP.
b. Copia del proyecto de investigación, según la estructura señalada en el Anexo Nº 7.
CAPÍTULO V
LICENCIA PARA LA IMPORTACIÓN DE CANNABIS Y SUS DERIVADOS Y/O COMERCIALIZACIÓN DE DERIVADOS DE CANNABIS
Artículo 11.- Licencia para la importación de cannabis y sus derivados y/o comercialización de derivados de cannabis
La licencia para la importación de cannabis y sus derivados y/o comercialización de derivados de cannabis, se otorga a los laboratorios farmacéuticos, droguerías, farmacias, boticas y farmacias de establecimientos de salud, según corresponda:
11.1. Licencia para la importación de cannabis y sus derivados y comercialización de derivados de cannabis a los laboratorios farmacéuticos y droguerías
La licencia para la importación de cannabis y sus derivados y comercialización de derivados de cannabis, se otorga a los laboratorios farmacéuticos y droguerías autorizados por la DIGEMID, por las Direcciones Regionales de Salud (DIRESAS), o las que hagan sus veces a nivel regional, en cumplimiento de las condiciones establecidas en el Reglamento de Establecimientos Farmacéuticos, aprobado por Decreto Supremo Nº 014-2011-SA; para lo cual el interesado debe presentar la siguiente información:
a. Formato de solicitud de licencia para la importación de cannabis y sus derivados y comercialización de derivados de cannabis, conforme al modelo publicado en la página web de la DIGEMID, que debe ser suscrita por el/la director/a técnico/a y por el/la representante legal del establecimiento farmacéutico, y que contiene:
– Nombres y apellidos o razón social del establecimiento farmacéutico.
– Número de Registro Único de Contribuyente (RUC) del establecimiento farmacéutico.
– Número de registro del establecimiento farmacéutico.
– Nombre, número de teléfono y correo electrónico del representante legal.
– Nombre comercial y dirección del establecimiento farmacéutico.
– Nombre y número de colegiatura del profesional Químico Farmacéutico que asume la dirección técnica.
– Número de la certificación de Buenas Prácticas de Manufactura o del certificado de Buenas Prácticas de Almacenamiento, según corresponda.
– Número de comprobante de pago y fecha de emisión.
– Número del certificado de cumplimiento de dispositivos de seguridad para el desarrollo de actividades con cannabis y sus derivados, regulado para el uso medicinal y terapéutico, emitido por la DIRANDRO de la PNP.
b. Declaración jurada de comercialización exclusiva a farmacias, boticas y farmacias de los establecimientos de salud que cuenten con la licencia de comercialización de derivados de cannabis, para garantizar el control y trazabilidad del producto.
c. Declaración jurada de comercialización exclusiva a droguerías que cuenten con la licencia para la importación de cannabis y sus derivados y comercialización de derivados de cannabis a los laboratorios farmacéuticos y droguerías, en los casos que corresponda.
d. Declaración jurada del representante legal y de personas vinculadas con la seguridad y manipulación, de no contar con antecedentes policiales, penales y judiciales por delito de tráfico ilícito de drogas y conexos.
La licencia para la importación de cannabis y sus derivados y/o comercialización de derivados de cannabis a los laboratorios farmacéuticos y droguerías en Lima Metropolitana están a cargo de la DIGEMID, y en el caso de las droguerías de nivel regional, están a cargo de las DIRESAS o las que hagan sus veces; el trámite a efectos de obtener dicha licencia se efectúa a través de la Ventanilla Única de Comercio Exterior – VUCE.
11.2. Licencia para la comercialización de derivados de cannabis a las farmacias, boticas y farmacias de establecimientos de salud
La licencia para la comercialización de derivados de cannabis se otorga a farmacias, boticas y farmacias de establecimientos de salud autorizados por las DIRIS, las DIRESAS o las que hagan sus veces a nivel regional, en cumplimiento de las condiciones establecidas en el Reglamento de Establecimientos Farmacéuticos, aprobado por Decreto Supremo Nº 014-2011-SA; para lo cual el interesado debe presentar a las DIRIS, las DIRESAS o las que hagan sus veces a nivel regional, la siguiente información:
a. Formato de solicitud de licencia para comercialización de derivados de cannabis para uso medicinal y terapéutico conforme al modelo publicado en la página web de la DIGEMID, que debe ser suscrito por el/la director/a técnico/a y por el/la representante legal del establecimiento farmacéutico, y que contiene:
– Nombres y apellidos o razón social del establecimiento farmacéutico.
– Número de Registro Único de Contribuyente (RUC) del establecimiento farmacéutico.
– Número de Registro de establecimiento farmacéutico.
– Nombre, número de teléfono y correo electrónico del representante legal.
– Nombre comercial y dirección del establecimiento farmacéutico.
– Nombre y número de colegiatura del profesional Químico Farmacéutico que asume la dirección técnica.
– Relación de productos a comercializar.
– Número de la certificación de Buenas Prácticas de Oficina Farmacéutica.
– Número de comprobante de pago y fecha de emisión.
– Número del certificado de cumplimiento de dispositivos de seguridad para el desarrollo de actividades con cannabis y sus derivados, regulado para el uso medicinal y terapéutico, emitido por la DIRANDRO de la PNP.
b. Declaración jurada de comercialización exclusiva a pacientes que se encuentran inscritos en el RENPUC.
c. Declaración jurada del representante legal y de personas vinculadas con la seguridad y manipulación, de no contar con antecedentes policiales, penales y judiciales por delito de tráfico ilícito de drogas y conexos.
La Licencia para la comercialización de derivados de cannabis a las farmacias, boticas y farmacias de establecimientos de salud de Lima Metropolitana está a cargo de las DIRIS o quienes hagan sus veces, y las de nivel regional a cargo de las DIRESAS o quienes hagan sus veces.
Artículo 12.- Proceso de importación
12.1. Pueden importar cannabis, semillas de cannabis y derivados de cannabis para uso medicinal y terapéutico los establecimientos farmacéuticos que cuenten con la licencia correspondiente.
12.2. La importación de cannabis, derivados de cannabis para uso medicinal y terapéutico, cuyo contenido es igual o superior al 1% a más de tetrahidrocannabinol (Cannabis psicoactivo), está condicionada a la obtención del Certificado Oficial de Importación, según lo establecido en las disposiciones del Reglamento de Estupefacientes, Psicotrópicos y otras Sustancias Sujetas a Fiscalización Sanitaria, aprobado por Decreto Supremo Nº 023-2001-SA, y sus modificatorias.
Además, debe también adjuntarse el Certificado de Análisis emitido por el fabricante, el mismo que será presentado ante la DIGEMID.
12.3. Para la importación de cannabis, derivados de cannabis cuyo contenido es predominantemente cannabidiol e inferior al 1% de tetrahidrocannabinol (Cannabis no psicoactivo), previo sustento a través de un Certificado de Análisis, la DIGEMID emite un documento de no objeción para importación, requisito exigible para el despacho aduanero. El trámite a efectos de obtener dicho documento se efectúa a través de la Ventanilla Única de Comercio Exterior – VUCE.
12.4. La Administración Aduanera dispone el reembarque de cannabis y derivados del cannabis, señalados en los numerales 12.2 y 12.3 para uso medicinal y terapéutico que no cuenten con Certificado Oficial de Importación o el documento de no objeción para importación, respectivamente.
12.5. Para el caso de importación o adquisición de productos terminados derivados de cannabis con fines de investigación científica, no es necesaria la obtención previa de una licencia de importación y/o comercialización, siempre que la universidad o institución de investigación haya obtenido la correspondiente licencia de investigación científica.
12.6. Para la importación de cannabis y semillas de cannabis, se debe contar además de la licencia correspondiente, con la autorización emitida por el SENASA y dar cumplimiento a las disposiciones establecidas en el control fitosanitario.
Artículo 13.- Autorización excepcional de importación
13.1. En el marco del literal d) del artículo 20 del Reglamento para el Registro, Control y Vigilancia Sanitaria de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios, aprobado por Decreto Supremo Nº 016-2011-SA y su modificatoria, la DIGEMID otorga la autorización excepcional de importación de derivados de cannabis para uso medicinal y terapéutico para tratamiento individual.
13.2. Para la obtención de la autorización excepcional para tratamiento individual se presenta el formato de solicitud, conforme al modelo publicado en la página web de la DIGEMID, y la prescripción en receta médica o receta especial, para lo cual se requiere que el paciente se encuentre inscrito en el RENPUC.
13.3. La receta médica o receta especial autorizada por la DIGEMID se presenta ante la Superintendencia Nacional de Aduanas y de Administración Tributaria (SUNAT) para el trámite de importación de derivados del cannabis para uso medicinal y terapéutico. Este trámite puede ser realizado por un tercero que tenga a su cargo el cuidado o tutela del paciente, cuyos nombres y apellidos completos deben consignarse en la parte posterior de la receta.
Sólo para este trámite, la receta médica o receta especial puede contener la prescripción hasta por un máximo de seis (6) meses de tratamiento.
13.4. La importación de derivados de cannabis para tratamiento individual se realiza por las distintas aduanas del país.
Artículo 14.- De las actividades de comercialización y de la promoción y publicidad
14.1. Para comercializar los derivados del cannabis para uso medicinal y terapéutico, las farmacias, boticas y farmacias de los establecimientos de salud deben abastecerse de droguerías y laboratorios farmacéuticos. Para tal efecto, han de estar debidamente autorizadas con la licencia que corresponda, para dichas actividades de comercio.
14.2. No se permite la comercialización o dispensación de los preparados farmacéuticos y productos terminados en consultorios profesionales y fuera del establecimiento farmacéutico autorizado con la licencia que corresponda.
14.3. Se permite la comercialización de semillas de cannabis producidas en el país a aquellos que cuenten con la licencia de producción de derivados de cannabis con cultivo. Asimismo, se debe cumplir con lo establecido en la Ley Nº 27262, Ley General de Semilla, y sus normas reglamentarias correspondientes.
14.4. La comercialización a domicilio solo está permitida para los productos derivados de cannabis que en su formulación contengan cantidades inferiores al 1% de tetrahidrocannabinol (THC) o cuando sólo contenga cannabidiol (CBD), para los pacientes que hayan culminado con el proceso de registro en el RENPUC, como usuarios de cannabis para uso medicinal y terapéutico.
14.5. Queda prohibida la comercialización del cannabis y sus derivados de la producción artesanal de derivados del cannabis con cultivo asociativo de la planta del género cannabis, por ser ésta de exclusivo beneficio de los pacientes calificados que integran las asociaciones de pacientes usuarios del cannabis.
14.6. Queda prohibida la promoción y publicidad de cannabis y sus derivados para uso medicinal y terapéutico, que incluye la entrega de muestras promocionales en las formas de muestra médica o de originales de obsequio.
CAPÍTULO VI
LICENCIA PARA LA PRODUCCIÓN DE DERIVADOS DE CANNABIS, CON O SIN CULTIVO DE LA PLANTA DEL GÉNERO CANNABIS
Artículo 15.- Licencia para la producción de derivados de cannabis, con o sin cultivo de la planta del género cannabis
15.1. La licencia para la producción de derivados de cannabis, con o sin cultivo de la planta del género cannabis faculta a la realización de las siguientes actividades: Adquisición de semillas de cannabis, siembra, propagación, cultivo, cosecha, post-cosecha, fabricación, acondicionado y reacondicionado de productos derivados de cannabis, así como actividades de almacenamiento y transporte de semillas, plántulas, plantas, flores y productos derivados de cannabis para uso medicinal y terapéutico.
La licencia para la producción de derivados de cannabis, con o sin cultivo de la planta del género cannabis es otorgada por la DIGEMID únicamente a las entidades públicas o laboratorios farmacéuticos, en cumplimiento de las condiciones establecidas en el Reglamento de Establecimientos Farmacéuticos, aprobado por Decreto Supremo Nº 014-2011-SA.
15.2. La licencia para la producción de derivados de cannabis de la planta del género cannabis puede ser de dos (2) tipos:
a. Licencia para la producción de derivados de cannabis, con cultivo de la planta del género cannabis.
b. Licencia para la producción de derivados de cannabis, sin cultivo de la planta del género cannabis.
Para el caso de producción con cultivo, el SENASA regula las actividades de producción, certificación y comercialización de semillas.
15.3. Para la obtención de la licencia para la producción de derivados de cannabis con cultivo de la planta del género cannabis, el interesado debe presentar lo siguiente:
a. Formato de solicitud de licencia para la producción de derivados de cannabis con cultivo de la planta del género cannabis, conforme al modelo publicado en la página web de la DIGEMID, la que debe ser suscrita por el/la director/a técnico/a y por el/la representante legal del establecimiento farmacéutico o entidad pública que corresponda, que contiene:
– Nombres y apellidos o razón social del laboratorio farmacéutico o razón social de la entidad pública.
– Número de Registro Único de Contribuyente (RUC) del laboratorio farmacéutico o de la entidad pública.
– Número de Registro del laboratorio farmacéutico.
– Nombre, número de teléfono y correo electrónico del representante legal.
– Nombre comercial y dirección del laboratorio farmacéutico.
– Nombre y número de colegiatura del profesional Químico Farmacéutico que asume la dirección técnica.
– Nombres y números de colegiatura de los profesionales Químicos Farmacéuticos asistentes.
– Actividades de producción.
– Número de certificación de buenas prácticas, según corresponda.
– Número de comprobante de pago y fecha de emisión.
– Nombre del encargado que maneja el cultivo o responsable técnico, de corresponder.
– Número del certificado de cumplimiento de dispositivos de seguridad para el desarrollo de actividades con cannabis y sus derivados, regulado para el uso medicinal y terapéutico, emitido por la DIRANDRO de la PNP.
b. Copia del Plan de producción para la fabricación de los derivados del cannabis para uso medicinal y terapéutico y productos que lo contienen.
c. Copia del Plan de producción agrícola, conforme a lo dispuesto en el artículo 18 del presente Reglamento.
d. Declaración jurada del representante legal y de personas vinculadas con la seguridad y manipulación, de no contar con antecedentes policiales, penales y judiciales por delito de tráfico ilícito de drogas y conexos.
La licencia para la producción de derivados de cannabis con cultivo de la planta del género cannabis es otorgada por la DIGEMID, previa opinión favorable del MIDAGRI sobre el Plan de producción agrícola presentado por el/la administrado/a para obtener la citada licencia.
15.4. Para la obtención de la licencia para la producción de derivados de cannabis sin cultivo de la planta del género cannabis, la entidad pública o laboratorio farmacéutico que solicite la licencia debe presentar los requisitos señalados por el numeral 15.3 del presente artículo, a excepción de lo dispuesto en el literal c) del mencionado numeral.
15.5. Admitida a trámite la solicitud de la licencia para la producción de derivados de cannabis con cultivo de la planta del género cannabis, la DIGEMID remite la copia del Plan de producción agrícola, a efecto que la Dirección General de Desarrollo Agrícola y Agroecología o la que haga sus veces del MIDAGRI emita la opinión sobre el contenido del citado Plan, en un plazo no mayor a diez (10) días hábiles, previa inspección técnica.
15.6. En el caso de licencia para la producción de derivados de cannabis con cultivo de la planta del género cannabis, de mediar observaciones al Plan de producción agrícola, la Dirección General de Desarrollo Agrícola y Agroecología o la que haga sus veces del MIDAGRI, mediante comunicación, otorga al solicitante un plazo máximo de diez (10) días hábiles para el levantamiento de las observaciones formuladas, con conocimiento de la DIGEMID.
Dicha comunicación suspende el plazo de atención del procedimiento para el otorgamiento de la licencia para la producción con cultivo. Vencido dicho plazo, con o sin levantamiento de observaciones, la Dirección General de Desarrollo Agrícola y Agroecología o la que haga sus veces del MIDAGRI emite pronunciamiento, con conocimiento de la DIGEMID.
15.7. El/la titular de la licencia para la producción de derivados de cannabis con cultivo de la planta del género cannabis, de forma anual debe presentar una declaración jurada en la que señale que mantiene las condiciones bajo las cuales fue otorgada la referida licencia; asimismo, debe comunicar previamente a la DIGEMID, la modificación del encargado que maneja el cultivo o responsable técnico del mismo, cuando corresponda.
Artículo 16.- Modificación de la licencia para la producción de derivados de cannabis, con o sin cultivo de la planta del género cannabis
16.1. Para tramitar la modificación de la licencia para la producción de derivados de cannabis, con o sin cultivo de la planta del género cannabis, se debe presentar ante la DIGEMID lo siguiente:
a. Formato de solicitud de licencia para la producción de derivados de cannabis, con cultivo de la planta del género cannabis conforme al modelo publicado en la página web de la DIGEMID, la que debe ser suscrita por el/la director/a técnico/a y por el/la representante legal del establecimiento farmacéutico o entidad pública que corresponda, que contiene:
– Nombres y apellidos o razón social del laboratorio farmacéutico o razón social de la entidad pública.
– Número de Registro Único de Contribuyente (RUC) del laboratorio farmacéutico o de la entidad pública.
– Número de Registro del laboratorio farmacéutico.
– Nombre, número de teléfono y correo electrónico del representante legal.
– Nombre comercial y dirección del laboratorio farmacéutico.
– Número de licencia para la producción.
– Declaración jurada de no variación de la información contenida en los literales del numeral 15.3 del artículo 15 del presente Reglamento.
– Número del certificado de cumplimiento de dispositivos de seguridad para el desarrollo de actividades con cannabis y sus derivados, regulado para el uso medicinal y terapéutico, emitido por la DIRANDRO de la PNP.
– Número de comprobante de pago y fecha de emisión.
b. Copia del nuevo Plan de producción para la fabricación de los derivados del cannabis para uso medicinal y terapéutico y productos que lo contienen, de haberse modificado el referido Plan.
c. Copia del nuevo Plan de producción agrícola, de acuerdo al formato establecido en el Anexo Nº 2 del presente Reglamento, sólo para los casos de la modificación de la licencia para la producción de derivados de cannabis con cultivo de la planta del género cannabis, de haberse modificado el referido Plan.
16.2. Para la modificación de la licencia para la producción de derivados de cannabis sin cultivo de la planta del género cannabis, la entidad pública o laboratorio farmacéutico que solicite la modificación debe presentar los requisitos señalados por el numeral 16.1 del presente artículo, a excepción de lo dispuesto en el literal c) del mencionado numeral.
16.3. La calificación del procedimiento modificación de la licencia para la producción de derivados de cannabis, con o sin cultivo de la planta del género cannabis, es de evaluación previa sujeto a silencio administrativo negativo, cuyo plazo de atención es de treinta (30) días hábiles.
16.4. La realización de modificaciones en la producción de derivados de cannabis con o sin cultivo de la planta del género cannabis previamente debe ser aprobada por la DIGEMID antes de su ejecución.
16.5. La Dirección General de Desarrollo Agrícola y Agroecología o la que haga sus veces del MIDAGRI evalúa el nuevo Plan de producción agrícola para la modificación de la licencia para la producción de derivados de cannabis con cultivo de la planta del género cannabis, según lo dispuesto en los numerales 15.5 y 15.6 del artículo 15 del presente Reglamento.
Artículo 17.- Control fitosanitario en la importación de cannabis y semillas de cannabis para uso medicinal y terapéutico.
El control fitosanitario en la importación de cannabis y semillas de cannabis se aplica a todos los envíos de cannabis o sus semillas destinadas al uso medicinal y terapéutico. Los requisitos fitosanitarios de necesario cumplimiento para la importación de cannabis y semillas de cannabis son elaborados en base a los estudios de Análisis de Riesgo de Plagas y son aprobados por el SENASA mediante documento normativo.
El ingreso al país de envíos de cannabis y semillas de cannabis se sujeta a las disposiciones establecidas por el SENASA, de acuerdo a su competencia. La importación de semillas de cannabis está sujeta al seguimiento del cultivo bajo cuarentena posentrada. Para la importación de cannabis y semillas de cannabis, el SENASA emite el Permiso Fitosanitario de Importación cuando se cuente previamente con la licencia correspondiente.
Artículo 18.- Plan de Producción Agrícola
18.1. El Plan de producción agrícola es el documento de carácter confidencial que describe las responsabilidades que debe cumplir el/la administrado/a en la etapa de producción agrícola de cannabis para uso medicinal y terapéutico, así como los procedimientos que son implementados en el lugar de producción autorizado, la cantidad estimada de semillas y/o plantas a utilizar, la procedencia u origen y las especificaciones técnicas de los insumos que utilizan para dicha producción.
El MIDAGRI, como Autoridad competente sobre la materia, establece los lineamientos del Plan de producción agrícola.
18.2. Para efectos de la evaluación del Plan de producción agrícola por parte del MIDAGRI, dicho Plan debe ser presentado ante la DIGEMID conteniendo la siguiente información:
a. Plan de producción agrícola de cannabis con fines medicinales y terapéuticos, según formato del Anexo Nº 2 del presente Reglamento; este debe tener una validación interna donde figure los apellidos, nombres y firma de la persona que lo elabora y revisado y validado por el/la representante legal. El referido Plan debe contener el cronograma de trabajo firmado por el representante legal del administrado y el responsable técnico del cultivo para cada actividad.
b. Copia literal de dominio o certificado de posesión del predio agrícola emitido por la Autoridad competente, donde será instalado el cultivo de Cannabis con fines medicinales y terapéuticos.
c. Plano perimétrico del predio debidamente georreferenciado en coordenadas UTM (Datum WGS84), elaborado por un/a ingeniero/a agrícola o agrónomo/a o civil, debidamente colegiado/a y habilitado/a.
d. Memoria descriptiva del predio, indicando lo siguiente:
d.1. Ubicación política: Sector/Anexo, distrito, provincia, región.
d.2. Croquis o plano de ubicación señalando:
– Vías de acceso: Principales y secundarias.
– Linderos, indicando cuando corresponda, los nombres de los/las propietarios/as de los predios colindantes.
d.3. Plano de distribución de las áreas de cultivo, infraestructura de riego y edificaciones, debidamente señalados.
18.3. La Dirección General de Desarrollo Agrícola y Agroecología o la que haga sus veces del MIDAGRI efectúa el seguimiento al cumplimiento del Plan de Producción Agrícola. El/la administrado/a titular de la licencia para la producción con cultivo está obligado a implementar los registros de siembra, cosecha, destrucción y manejo de residuos de cannabis y listado de insumos utilizados en la producción, conforme a los Anexos Nº 3, 4, 5 y 6 del presente Reglamento, que deben estar a disposición de las autoridades competentes.
18.4. La Dirección General de Desarrollo Agrícola y Agroecología o la que haga sus veces del MIDAGRI tiene la potestad de verificar el cumplimiento del Plan de Producción Agrícola a través de visitas inopinadas a la zona de producción agrícola, de manera independiente o en conjunto con el MININTER y el MINSA; y, de encontrar algún incumplimiento no justificado del Plan por parte del administrado, esta Dirección debe reportar los hallazgos a la DIGEMID para conocimiento y fines pertinentes sobre las licencias otorgadas.
18.5. La modificación al Plan de Producción Agrícola en cuanto al área de producción agrícola, cantidad de semillas, cantidad estimada de cosecha, tecnología y/o manejo de cultivo, conlleva a la modificación de la licencia para la producción con cultivo de cannabis.
Artículo 19.- Plan de producción para la fabricación de los derivados del cannabis para uso medicinal y terapéutico y productos que lo contienen
19.1. El Plan de producción para la fabricación de los derivados del cannabis para uso medicinal y terapéutico y productos que lo contienen es el documento de carácter confidencial que debe contener el cronograma de trabajo y el organigrama funcional del solicitante, en el cual se señalen las responsabilidades y labores de cada uno de los/las empleados/as, ya sean personas naturales o jurídicas, que están involucrados en la etapa de fabricación de los derivados de cannabis para uso medicinal y terapéutico y productos que los contienen, y el monto de las inversiones necesarias para la ejecución de dichas actividades.
19.2. El Plan de producción para la fabricación también debe contener:
a) Los procedimientos de transformación (desde la etapa de post cosecha) y de control de calidad que son implementados en el área de fabricación.
b) El volumen estimado de fabricación de productos derivados de cannabis para uso medicinal y terapéutico.
c) Un estimativo de la cantidad y especificaciones técnicas del cannabis para uso medicinal y terapéutico que se empleará.
d) Indicación del origen de la cosecha que se va a usar.
e) Un plano de las instalaciones de fabricación donde se muestren las distintas áreas.
f) Metodología para realizar control del contenido de metabolitos sometidos a fiscalización durante sus etapas de fabricación. En el caso de los laboratorios que realicen solo acondicionado y/o reacondicionado, deben presentar, en lugar de Plan de producción, el flujograma del proceso de acondicionado y reacondicionado.
19.3. El Plan de producción debe estar suscrito por el/la representante legal y el/la director/a técnico/a.
19.4. Corresponde a la DIGEMID, a través de la Dirección de Inspección y Certificaciones, emitir opinión favorable del Plan de producción para la fabricación de los derivados del cannabis para uso medicinal y productos que lo continen.
Artículo 20.- De las actividades de producción
20.1. Las actividades de producción abarcan desde la adquisición u obtención de la semilla o plántula, siembra, multiplicación, manejo, cosecha y post cosecha, obtención de un derivado de cannabis para uso medicinal y terapéutico, proceso de manufactura y envasado, así como el reacondicionado, hasta llegar al producto terminado. Los laboratorios farmacéuticos que se dedican sólo al acondicionado y reacondicionado se acogen a la licencia para la producción que no incluye cultivo del presente Reglamento. Para la producción de semillas, se debe cumplir las disposiciones establecidas por la Ley Nº 27262, Ley General de Semilla, y sus normas reglamentarias correspondientes.
20.2. La producción de derivados de cannabis para uso medicinal y terapéutico se rige por las disposiciones del Título Cuarto del Reglamento de Estupefacientes, Psicotrópicos y otras Sustancias Sujetas a Fiscalización Sanitaria, aprobado por Decreto Supremo Nº 023-2001-SA.
20.3. Con la finalidad de cuantificar las necesidades del país y establecer la cantidad total requerida en materia de cannabis y sus derivados con fines medicinales y terapéuticos, el MINSA a través de la DIGEMID, determina las previsiones anuales de conformidad con el artículo 5 del Reglamento de Estupefacientes, Psicotrópicos y Otras Sustancias sujetas a fiscalización sanitaria, aprobado por Decreto Supremo Nº 023-2001-SA, y sus modificatorias. Para tal fin, se convoca al MIDAGRI y al MININTER para la validación de la información, según sus competencias.
CAPÍTULO VII
LICENCIA PARA LA PRODUCCIÓN ARTESANAL DE DERIVADOS DE CANNABIS CON CULTIVO ASOCIATIVO DE LA PLANTA DEL GÉNERO CANNABIS, CON FINES MEDICINALES Y TERAPÉUTICOS
Artículo 21.- Asociaciones para la producción artesanal con cultivo asociativo
21.1. Las asociaciones para la producción artesanal con cultivo asociativo de la planta del género cannabis con fines medicinales y terapéuticos son creadas para lograr el acceso a los/las pacientes para mejorar su calidad de vida, las mismas que están conformadas por dos (02) o más pacientes o representantes legales o sus apoyos designados, inscritos en el RENPUC, para exclusivo beneficio de lo/as pacientes calificados que las integran.
21.2. Las asociaciones para la producción artesanal con cultivo asociativo de la planta del género cannabis con fines medicinales y terapéuticos operan ante la administración pública a través de sus representantes legales, quienes actúan premunidos de sus respectivos poderes.
21.3. El cannabis y sus derivados de la producción artesanal con cultivo asociativo de la planta del género cannabis con fines medicinales y terapéuticos, generados por la asociación, son para exclusivo beneficio de los/las pacientes calificado/as que integran las mismas; por tanto, dichos productos derivados no pueden comercializarse ni transferirse a terceros.
Artículo 22.- Licencia para la producción artesanal de derivados de cannabis con cultivo asociativo de la planta del género cannabis, con fines medicinales y terapéuticos
22.1. La licencia para la producción artesanal de derivados de cannabis con cultivo asociativo de la planta del género cannabis, con fines medicinales y terapéuticos se otorga a las asociaciones de pacientes, debidamente acreditadas y certificadas, y faculta la realización de las siguientes actividades: Siembra, manejo, cosecha y post cosecha, procesamiento, transporte y almacenamiento de cannabis para fines medicinales y terapéuticos. Pueden adquirir las semillas de aquellos que cuenten con la licencia para la producción de derivado de cannabis con cultivo de la planta del género cannabis.
22.2. La licencia para la producción artesanal de derivados de cannabis con cultivo asociativo de la planta del género cannabis, con fines medicinales y terapéuticos es otorgada por la DIGEMID (Lima Metropolitana) y las Direcciones Regionales de Medicamentos, Insumos y Drogas o las que hagan sus veces.
22.3. Las ampliaciones o modificaciones de la información declarada para la obtención de la licencia deben ser comunicadas a la DIRANDRO de la PNP por la Autoridad sanitaria competente que otorgó la misma.
Artículo 23.- Procedimiento para la obtención de la licencia para la producción artesanal de derivados de cannabis con cultivo asociativo de la planta del género cannabis, con f nes medicinales y terapéuticos
23.1. Para la obtención de la licencia el interesado debe presentar la siguiente información:
a) Formato de solicitud de licencia para la producción artesanal de derivados de cannabis con cultivo asociativo de la planta del género cannabis, con fines medicinales y terapéuticos, conforme al modelo publicado en la página web de la DIGEMID, que debe ser suscrito por el/la representante legal de la asociación, y que contiene:
– Datos del solicitante: Nombre o razón social de la asociación, domicilio legal de la asociación, teléfono, horario de funcionamiento, lugar donde se lleva a cabo el cultivo y la producción, Registro Único de Contribuyente (RUC), y datos del representante legal.
– Número de partida registral de la asociación.
– Número de partida registral de la vigencia de poderes del representante legal de la asociación.
– Nombre del encargado del cultivo asociativo responsable del cultivo, procesamiento, transporte y almacenamiento del cannabis.
– Nombre del encargado de la producción artesanal responsable del procesamiento, transporte y almacenamiento del cannabis para uso medicinal y terapéutico.
– Nombres de lo/as pacientes o representantes legales o sus apoyos designados, inscritos en el RENPUC, pertenecientes a la asociación.
– Número del certificado de cumplimiento de dispositivos de seguridad para el desarrollo de actividades con cannabis y sus derivados, regulado para el uso medicinal y terapéutico, emitido por la DIRANDRO de la PNP, del lugar donde se realiza la actividad de cultivo y producción.
– Número de comprobante de pago y fecha de emisión.
b) Declaración jurada de no contar con antecedentes policiales, penales y judiciales por delito de tráfico ilícito de drogas y conexos del representante legal de la asociación y de las personas vinculadas con la seguridad y manipulación del cannabis y sus derivados.
c) Formato de justificación médica de cada paciente usuario del cannabis y sus derivados inscrito en el RENPUC, perteneciente a la asociación, conforme al modelo publicado en la página web de la DIGEMID, que debe ser suscrito por el médico tratante.
d) Copia del Plan del cultivo, procesamiento, transporte y almacenamiento de cannabis y sus derivados para fines medicinales y terapéuticos, que contenga:
i. Métodos a utilizar en el procesamiento del cannabis y sus derivados para fines medicinales y terapéuticos; y, número de análisis de control de calidad a realizar por la asociación a los derivados del cannabis.
ii. Flujograma general del proceso de producción, indicando los puntos críticos de control de los diferentes parámetros del proceso del cannabis y sus derivados para fines medicinales y terapéuticos, y el croquis de las instalaciones del cultivo y producción.
iii. El volumen estimado de producción artesanal de productos derivados de cannabis para uso medicinal y terapéutico, que debe ser proporcional a la cantidad de pacientes asociados y su prescripción.
iv. Estimado de la cantidad y especificaciones técnicas del cannabis para uso medicinal y terapéutico que se emplea, la que debe ser proporcional a la cantidad de pacientes asociados y su prescripción.
23.2. El Plan del cultivo, procesamiento, transporte y almacenamiento de cannabis y sus derivados para fines medicinales y terapéuticos debe estar suscrito por el representante legal, por el encargado del cultivo asociativo responsable del manejo del cultivo, procesamiento, transporte y almacenamiento del cannabis, y por el encargado de la producción artesanal responsable del procesamiento, transporte y almacenamiento del cannabis para uso medicinal y terapéutico. Antes de expedirse la licencia, el citado plan es remitido por la DIGEMID a la Dirección General de Desarrollo Agrícola y Agroecología o la que haga sus veces del MIDAGRI, para su opinión y recomendaciones en lo que corresponda, en un plazo no mayor a diez (10) días hábiles.
23.3. Los/las pacientes usuarios del cannabis y sus derivados, o sus apoyos designados o representantes legales, deben estar inscritos en el RENPUC antes de presentar la solicitud de licencia de la asociación para la producción artesanal de derivados de cannabis con cultivo asociativo con fines medicinales y terapéuticos.
23.4. Las asociaciones deben realizar los análisis de control de calidad de los derivados de cannabis, conforme a lo manifestado en el Plan del cultivo, procesamiento, transporte y almacenamiento de cannabis y sus derivados para fines medicinales y terapéuticos.
Artículo 24.- De las previsiones y balances anuales
A efecto que la DIGEMID informe internacionalmente la cantidad de cannabis para uso medicinal producido en el país, las asociaciones deben consignar en el registro correspondiente:
a) Las previsiones anuales del cannabis y sus derivados, hasta el 31 de marzo de cada año;
b) Los balances trimestrales relativos al empleo o disposición del cannabis y sus derivados, cuyos datos deben sustentarse en las recetas médicas de los Médicos tratantes. El primer balance corresponde al trimestre que termina en el mes de marzo de cada año.
Las asociaciones pueden solicitar previsiones suplementarias con la debida justificación a la DIGEMID. De ser aceptadas dichas previsiones, estas son consignadas en el registro correspondiente.
De no presentarse las previsiones y balances según lo dispuesto en el presente artículo, la DIGEMID comunica este hecho a la DIRANDRO.
CAPÍTULO VIII
PRESCRIPCIÓN Y TRATAMIENTO MÉDICO
Artículo 25.- Prescripción médica
25.1. Sólo los/las Médicos Cirujanos prescriben derivados de cannabis con fines medicinales y terapéuticos.
25.2. Para la prescripción de dichos derivados debe emplearse la receta médica o receta especial, y consignar en forma clara y precisa, sin dejar espacios en blanco ni realizar enmendaduras, la siguiente información:
a. Nombre y apellidos del Médico Cirujano que la extiende, número de colegiatura, número de teléfono y dirección (con especificación del distrito y la ciudad).
b. Nombre y apellidos, dirección, número de teléfono y número del Documento Nacional de Identidad del paciente.
Tratándose de extranjeros, debe consignarse el número de pasaporte o del carné de extranjería.
c. Diagnóstico médico.
d. Nombre del derivado del cannabis para uso medicinal y terapéutico, objeto de la prescripción con su Denominación Común Internacional (DCI), si la tuviera.
e. Concentración del principio activo y forma farmacéutica.
f. Posología, indicando el número de unidades por toma y día, así como la duración del tratamiento.
g. Lugar, fecha de expedición, firma habitual del profesional que prescribe y sello.
25.3. La vigencia de la receta especial es hasta treinta (30) días calendario, contados a partir de su emisión.
Artículo 26.- Tratamiento médico
En cumplimiento a lo establecido en el artículo 7 de la Ley Nº 30681, Ley que regula el uso medicinal y terapéutico del Cannabis y sus derivados, el MINSA elabora, actualiza y aprueba los documentos normativos que orienten el tratamiento médico con cannabis y sus derivados con fines medicinales y terapéuticos, de acuerdo a la evidencia científica existente.
CAPÍTULO IX
ADQUISICIÓN, PRODUCCIÓN, ALMACENAMIENTO, CUSTODIA, DISPENSACIÓN Y CONTROL DE LOS DERIVADOS Y PRODUCTOS TERMINADOS DE CANNABIS PARA USO MEDICINAL Y TERAPÉUTICO
Artículo 27.- Responsable de la adquisición, producción, almacenamiento, custodia, dispensación y control de los derivados de cannabis para uso medicinal y terapéutico en los establecimientos farmacéuticos
El/la director/a técnico/a y el/la representante legal del establecimiento farmacéutico son solidariamente responsables de la adquisición, producción, almacenamiento, custodia, dispensación y control de los derivados de cannabis para uso medicinal y terapéutico, conforme a lo establecido en las normas correspondientes.
Artículo 28.- Adquisición de los derivados de cannabis para uso medicinal y terapéutico en las farmacias, boticas o farmacias de los establecimientos de salud del sector público y privado
Los/las pacientes o sus representantes legales o apoyos, para adquirir derivados de cannabis con fines medicinales y terapéuticos en las farmacias, boticas o farmacias de los establecimientos de salud del sector público y privado que cuentan con la licencia correspondiente, deben estar inscritos en el RENPUC.
Artículo 29.- Farmacovigilancia
29.1. El establecimiento farmacéutico que fabrica, importa y/o comercializa derivados de cannabis para uso medicinal y terapéutico debe cumplir con las Buenas Prácticas de Farmacovigilancia, e implementar y desarrollar actividades de farmacovigilancia según lo establecido en la NTS Nº 123-MINSA/DIGEMID-V.01: Norma Técnica de Salud que regula las actividades de Farmacovigilancia y Tecnovigilancia de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios, aprobada con Resolución Ministerial Nº 539-2016/MINSA, o la que haga sus veces.
29.2. El/la profesional de la salud debe reportar cualquier sospecha de reacción adversa que se pueda presentar con el uso de los productos derivados de cannabis para uso medicinal y terapéutico en los medios de notificación disponibles y dentro de los plazos establecidos de acuerdo a la normativa.
Artículo 30.- Dispensación en las farmacias, boticas o farmacias de los establecimientos de salud del sector público y privado
30.1. La dispensación se realiza previa presentación de la receta y constatación en el RENPUC por las farmacias, boticas o farmacias de los establecimientos de salud del sector público y privado, que cuenten con licencia de comercialización, que adicionalmente realizan la anotación de la dispensación en el Registro Nacional de Personas Naturales y Jurídicas que importan y/o comercializan cannabis y sus derivados para uso medicinal y terapéutico.
30.2. Las recetas una vez atendidas son retenidas por el establecimiento dispensador y quedan archivadas en éste por el término de dos (02) años.
En caso de entrega parcial de los productos prescritos, en el reverso de la receta se colocará las unidades dispensadas por el establecimiento, sello del establecimiento y firma del profesional Químico Farmacéutico.
CAPÍTULO X
PROTOCOLO DE SEGURIDAD
Artículo 31.- Protocolo de seguridad
31.1. El protocolo de seguridad tiene por objeto garantizar la intangibilidad física de cannabis y sus derivados, así como del producto terminado, evitando robos, hurtos u otras ocurrencias que generen disminución cuantitativa del cannabis y sus derivados para uso medicinal y terapéutico, a fin de que no sean desviados para usos ilícitos.
31.2. El protocolo de seguridad es formulado por el administrado, quien va a tramitar la(s) licencia(s) establecida(s) en el presente Reglamento, y requiere de una verificación de los dispositivos de seguridad existentes o implementados por el administrado en su establecimiento. La verificación es un servicio prestado en exclusividad por el Ministerio del Interior, a través de la DIRANDRO de la PNP quien expide el “Certificado de cumplimiento de dispositivos de seguridad para el desarrollo de actividades con cannabis y sus derivados, regulado para el uso medicinal y terapéutico”.
31.3. Para expedir el Certificado señalado en el numeral 31.2 del presente artículo, el/la administrado/a presenta ante la DIRANDRO de la PNP la siguiente documentación:
a) Solicitud con carácter de declaración jurada, conteniendo los datos personales del administrado.
b) El protocolo de seguridad, con la siguiente información:
i. Datos generales: Nombre del representante legal, conductor o responsable del establecimiento, número de Registro Único de Contribuyente (RUC), número de la Licencia de Funcionamiento Municipal con el giro de negocio relacionado a la actividad que realiza con el Cannabis y sus derivados, y domicilio legal.
ii. Datos del establecimiento donde se desarrolla la actividad: Dirección y ubicación geográfica referencial (captura de pantalla de mapa o coordenadas UTM).
iii. Documentación o descripción de los dispositivos de seguridad existentes o implementados, teniéndose en cuenta el tipo de actividad a desarrollar y los escenarios de riesgo que ella representa, de acuerdo con los lineamientos técnicos expresados en la Directiva que apruebe el Ministerio del Interior mediante Resolución Ministerial.
c) Pago por derecho de trámite.
31.4. La diligencia de verificación para la emisión del Certificado está a cargo de la DIRANDRO, la cual consta en un acta suscrita por el/la administrado/a, o su representante, y el personal de la DIRANDRO designado, en la que se señale la existencia o implementación de los dispositivos de seguridad en el establecimiento del administrado, conforme con los lineamientos técnicos que apruebe el Ministerio del Interior y el Protocolo de Seguridad presentado.
31.5. En caso de verificar la conformidad de la existencia o implementación de los dispositivos de seguridad en el establecimiento del administrado, la DIRANDRO emite el “Certificado de cumplimiento de dispositivos de seguridad para el desarrollo de actividades con cannabis y sus derivados, regulado para el uso medicinal y terapéutico”, que garantiza el cumplimiento de condiciones mínimas de seguridad.
31.6. De ser el caso que los representantes de la DIRANDRO constaten una observación a los dispositivos de seguridad en el establecimiento del administrado, dejan constancia de ello en la respectiva acta, a fin que el administrado proceda a su subsanación y posterior presentación de una nueva solicitud, de acuerdo con lo dispuesto en el numeral
31.3 del presente artículo.
Artículo 32.- Sobre la modificación del protocolo de seguridad
Toda modificación del protocolo de seguridad debe ser puesta en conocimiento de la DIRANDRO, siguiendo el proceso señalado en el numeral 31.3 del artículo 31 del presente Reglamento, para efectos de su verificación y actualización del Certificado otorgado, bajo apercibimiento de suspensión de la licencia.
CAPÍTULO XI
REGISTRO SANITARIO
Artículo 33.- Registro sanitario
33.1. El MINSA, a través de la DIGEMID, otorga registro sanitario a los productos derivados del cannabis de uso medicinal y terapéutico en la clasificación de especialidad farmacéutica o medicamento herbario, para cuyo efecto aplica el Reglamento para el Registro, Control y Vigilancia Sanitaria de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios, aprobado por Decreto Supremo Nº 016-2011-SA y sus modificatorias o el que haga sus veces, exceptuando lo señalado en el artículo 78 del citado Reglamento, sobre la inclusión en la formulación de sustancias estupefacientes.
33.2. Asimismo, el MINSA, a través de la DIGEMID, en un plazo máximo de treinta (30) días hábiles de solicitado, otorga el registro sanitario al producto natural derivado de cannabis de uso en salud, para cuyo efecto aplica lo establecido en el Reglamento para el Registro, Control y Vigilancia Sanitaria de Productos Farmacéuticos y Afines, aprobado con Decreto Supremo Nº 010-97-SA y sus modificatorias, o el que haga sus veces, referidos al producto natural de uso en salud. La información que debe contener el prospecto o inserto del producto natural derivado de cannabis de uso en salud es la establecida en los literales a), b), d), e) y f) del artículo 94 del citado Reglamento, así como la información referida al uso recomendado.
33.3. Los preparados de fórmulas magistrales derivados del cannabis para uso medicinal y terapéutico no requieren registro sanitario.
Artículo 34.- Condición de venta y/o dispensación
34.1. La venta y/o dispensación de derivados del cannabis para uso medicinal y terapéutico, cuando en su formulación el contenido de tetrahidrocannabinol (THC) es igual o superior al 1% (Cannabis psicoactivo), es con receta especial, la cual es retenida al momento de la dispensación y la venta; y, cuando en su formulación el contenido de tetrahidrocannabinol (THC) es inferior al 1% (Cannabis no psicoactivo) o cuando sólo contenga cannabidiol (CBD), la venta y/o dispensación debe realizarse con receta médica, la que es retenida al momento de la dispensación.
34.2. Los derivados de cannabis para uso medicinal y terapéutico prescritos en la receta médica y/o la receta especial, son dispensados en farmacias, boticas o farmacias de los establecimientos de salud, del sector público y privado, que cuenten con la licencia correspondiente.
CAPÍTULO XII
REGISTRO DE PACIENTES USUARIOS DEL CANNABIS Y SUS DERIVADOS PARA USO MEDICINAL Y TERAPÉUTICO
Artículo 35.- Registro de Pacientes Usuarios del Cannabis y sus derivados para uso medicinal y terapéutico (RENPUC)
Corresponde a la DIGEMID conducir el Registro Nacional de Pacientes Usuarios de Cannabis y sus derivados para uso medicinal y terapéutico (RENPUC), que para tal fin implementa.
Artículo 36.- Proceso de registro de pacientes usuarios del cannabis y sus derivados para uso medicinal y terapéutico
36.1. El/la paciente o el/la Médico tratante, a solicitud del paciente o sus representantes legales o apoyos, efectúa la inscripción correspondiente en el RENPUC, a través de una declaración jurada virtual que contiene la información requerida en el literal a) del artículo 4 y el artículo 6 de la Ley Nº 30681, Ley que regula el uso medicinal y terapéutico del Cannabis y sus derivados.
36.2. El registro se realiza en el portal web de la DIGEMID (www.digemid.minsa.gob.pe) o la que haga sus veces, para lo cual se ingresan los datos solicitados, conforme a lo dispuesto por la Ley Nº 29733, Ley de Protección de Datos Personales, y su modificatoria. El/la paciente da la conformidad a la recepción de la información sobre los beneficios y riesgos del tratamiento con cannabis y sus derivados, dispuesta por el artículo 6 de la Ley Nº 30681, Ley que regula el uso medicinal y terapéutico del Cannabis y sus derivados.
36.3. El proceso de registro culmina con la dispensación del derivado del cannabis por parte del establecimiento farmacéutico; en el caso de las asociaciones, el proceso de registro culmina con la entrega del derivado del cannabis por parte de la referida asociación, previa entrega de la receta médica a la misma.
Asimismo, puede realizarse el registro en la Plataforma de Usuario de los Centros y/o Establecimientos de Salud.
El/la paciente o su representante legal o apoyo da la conformidad a la recepción de la información sobre los beneficios y riesgos del tratamiento con cannabis y sus derivados, dispuesta por el artículo 6 de la Ley Nº 30681, Ley que regula el uso medicinal y terapéutico del Cannabis y sus derivados. Dicha información debe presentarse en lenguaje sencillo y en formato accesible, especialmente para personas con discapacidad, aplicando un enfoque intercultural que coadyuve a la generación de un servicio con pertinencia cultural en función a las características geográficas, ambientales, socioeconómicas, lingüísticas y culturales del paciente o sus representantes legales o apoyos.
CAPÍTULO XIII
REGISTROS DE IMPORTACIÓN Y/O COMERCIALIZACIÓN, INVESTIGACIÓN, PRODUCCIÓN Y PRODUCCIÓN ARTESANAL
Artículo 37.- Registro de personas naturales o jurídicas importadoras y/o comercializadoras y de asociaciones que realizan actividad de producción artesanal de derivados de cannabis con cultivo asociativo de la planta del género cannabis con fines medicinales y terapéuticos
Corresponde a la DIGEMID conducir el Registro de personas naturales o jurídicas importadoras y/o comercializadoras y de asociaciones que realizan actividad de producción artesanal de derivados de cannabis con cultivo asociativo de la planta del género cannabis con fines medicinales y terapéuticos, siendo dicho registro automático, y posterior a la emisión de la licencia correspondiente. Para el caso de las personas naturales y jurídicas importadoras y/o comercializadoras que se inscriben en el citado registro, deben estar constituidas como establecimientos farmacéuticos.
En el registro, los/las titulares de las licencias deben consignar el establecimiento farmacéutico o asociación, así como las previsiones y los movimientos relativos al empleo o disposición del cannabis y sus derivados.
Artículo 38.- Registro de universidades e instituciones de investigación autorizadas a estudiar el cannabis y sus derivados para uso medicinal y terapéutico
Corresponde al INS conducir el registro de las universidades e instituciones de investigación que realizan ensayos clínicos, siendo dicho registro automático luego de la emisión de la licencia.
Corresponde a la DIGEMID conducir el registro de las universidades e instituciones de investigación que realizan estudios preclínicos que cuentan con licencia, siendo dicho registro automático.
En el caso de investigaciones agrarias, corresponde al INIA conducir el Registro correspondiente.
Artículo 39.- Registro de entidades públicas y laboratorios debidamente registrados y certificados, autorizados para la producción
Corresponde a la DIGEMID conducir el Registro de entidades públicas y laboratorios debidamente registrados y certificados, autorizados para la producción; siendo dicho registro automático, y posterior a la emisión de la licencia correspondiente. Las personas naturales y jurídicas que se inscriben en el citado registro están constituidas como establecimientos farmacéuticos.
En el registro, los/las titulares de las licencias deben consignar el laboratorio farmacéutico, así como las previsiones y los movimientos relativos al empleo o disposición del cannabis y sus derivados.
CAPÍTULO XIV
CONTROL Y FISCALIZACIÓN
Artículo 40.- Control y fiscalización
40.1. El control abarca las actividades para la obtención de la planta de cannabis desde la semilla, siembra, manejo, cosecha y post cosecha, pasando por la obtención de un derivado de cannabis, proceso de manufactura, producción artesanal, hasta llegar al producto terminado, destinada a su uso medicinal y terapéutico.
40.2. Están sujetos al control y fiscalización los establecimientos farmacéuticos, universidades e instituciones, asociaciones para producción artesanal con cultivo asociativo, entidades públicas que cuenten con la licencia correspondiente para realizar actividades de investigación, producción, importación, comercialización del cannabis y sus derivados, y producción artesanal de derivados del cannabis con cultivo asociativo de la planta del género cannabis, destinados exclusivamente para fines medicinales y terapéuticos, así como los productos derivados de cannabis a cargo del MINSA, MIDAGRI y MININTER de acuerdo a sus competencias.
40.3. El MININTER, a través de la DIRANDRO de la PNP, garantiza el control, seguridad y fiscalización de las operaciones relacionadas con la producción de la planta de cannabis con fines medicinales y terapéuticos, que incluyen los procesos de producción, transporte, almacenamiento de materia prima y producto terminado. Para tal fin, los administrados deben brindar las facilidades al personal policial de la DIRANDRO y/o de sus órganos desconcentrados, encontrándose facultados para constituirse en el establecimiento donde se realiza la actividad, y/o solicitar información, con la finalidad de evitar que el cannabis y sus derivados sean desviados para usos ilícitos.
40.4. El SENASA realiza el control fitosanitario en la importación de cannabis y semillas de cannabis. Asimismo, como autoridad en semillas, debe efectuar la supervisión a las actividades de producción e importación de semillas de cannabis en el marco de la Ley Nº 27262, Ley General de Semillas, y sus normas reglamentarias correspondientes.
40.5. La acción contra el comercio ilegal de los derivados de cannabis se rige por las disposiciones del Capítulo IV del Título VI del Reglamento de Registro, Control y Vigilancia Sanitaria de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios, aprobado con Decreto Supremo Nº 016-2011-SA, y sus modificatorias.
Artículo 41.- Comunicación por siniestro o sustracción, pérdidas y mermas
41.1. Cuando se produzca un siniestro o la sustracción de cannabis y sus derivados para uso medicinal y terapéutico, el/la administrado/a el mismo día en que toma conocimiento del evento, denuncia el hecho ante la autoridad policial de la jurisdicción; y, copia del parte policial respectivo se presenta a la DIGEMID o a las Direcciones de Redes Integradas de Salud o a las Direcciones Regionales de Salud o a las que hagan sus veces a nivel regional, al siguiente día hábil, para que luego de la evaluación realizada por las citadas Autoridades, éstas autoricen el descargo del faltante en el registro
correspondiente.
41.2. Las pérdidas y las mermas por accidente de trabajo deben ser comunicadas con la justificación correspondiente a la DIGEMID o las Direcciones de Redes Integradas de Salud, las Direcciones Regionales de Salud o las que hagan sus veces a nivel regional, hasta el siguiente día hábil en que se tomó conocimiento.
41.3. Toda diferencia producida por siniestro, sustracción, pérdidas y mermas que no esté sustentada con la documentación correspondiente, da lugar a la investigación respectiva, a fin de determinar las responsabilidades administrativas, civiles o penales.
Artículo 42.- Control en el transporte
Los/las administrados/as están sujetos al control del transporte de cannabis y sus derivados para uso medicinal y terapéutico, exponiendo la documentación sustentatoria, permitiendo y facilitando la acción de control del producto; para tal efecto, el MININTER, a través de la PNP, ejecuta las acciones preventivas correspondientes.
Artículo 43.- Uso obligatorio de dispositivos de ubicación georreferenciada
El transporte de materias primas o derivados de cannabis para uso medicinal y terapéutico debe realizarse en unidades móviles que cuenten con dispositivos de ubicación georreferenciada, cuya información estará a disposición de la Policía Nacional del Perú – PNP y de la Superintendencia de Transporte Terrestre de Personas, Carga y Mercancías – SUTRAN.
Artículo 44.- Control de productos expirados, deteriorados, contaminados, alterados u otras observaciones sanitarias de cannabis y sus derivados para uso medicinal y terapéutico
Los establecimientos farmacéuticos, entidades públicas y asociaciones que cuenten con la licencia correspondiente deben comunicar a la DIGEMID o las Direcciones de Redes Integradas de Salud, las Direcciones Regionales de Salud o las que hagan sus veces a nivel regional, la relación de productos derivados de cannabis para uso medicinal y terapéutico, expirados, deteriorados, contaminados, alterados o con otras observaciones sanitarias, para su calificación como saldo descartable antes de proceder a su destrucción.
Artículo 45.- Destrucción del cannabis y sus derivados para uso medicinal y terapéutico
45.1. La destrucción de cannabis y sus derivados para uso medicinal y terapéutico se realiza teniendo en cuenta lo siguiente:
a) Los residuos de cannabis (semillas, plantas, restos de plantas o plántulas) y sus derivados para fines exclusivamente medicinales y terapéuticos, no utilizados en la producción, en la investigación y en la producción artesanal con cultivo asociativo, se incineran.
b) En el caso de los productos derivados de cannabis expirados, deteriorados, contaminados o alterados, o con otras observaciones sanitarias considerados como saldos descartables en la producción, en la investigación, en la comercialización e importación, su destrucción se realiza conforme a lo dispuesto por el Reglamento de Estupefacientes, Psicotrópicos y otras sustancias sujetas a fiscalización sanitaria, aprobado por Decreto Supremo Nº 023-2001-SA, y sus modificatorias.
En los casos de las asociaciones de producción artesanal con cultivo asociativo los productos son incinerados.
c) El mecanismo de destrucción de los residuos de cannabis y sus derivados sobrantes tras el proceso de producción, así como el manejo y disposición de sustancias sobrantes del proceso de producción, infestadas, especiales, peligrosas, tóxicas o de otro tipo debe permitir la incineración.
d) El procedimiento y medios técnicos a emplear para la disposición de residuos de cannabis y sus derivados para uso medicinal debe contemplar las medidas preventivas y de contingencia desde la generación hasta su destrucción.
e) Se debe cumplir con la normatividad nacional de la materia en relación a la gestión y manejo de los residuos del cannabis y sus derivados, sanitaria y ambientalmente adecuada, con sujeción a los principios de minimización, prevención de riesgos ambientales y protección de la salud y el bienestar de la persona humana, bajo cancelación de la licencia en caso de incumplimiento.
f) Cuando se trate de semillas de cannabis que no sean reutilizadas en un nuevo proyecto de producción o de investigación, deben ser incineradas; su incumplimiento es una causal de cancelación de la licencia, sin perjuicio de las responsabilidades administrativas, civiles y/o penales.
g) Cuando se trate de restos de plantas o plántulas de cannabis sobrantes en cualquiera de las etapas del proceso de producción, estos deben ser incinerados; el incumplimiento es una causal de cancelación de la licencia, sin perjuicio de las responsabilidades administrativas, civiles y/o penales a que hubiere lugar.
h) Todos los mecanismos de destrucción deben mantenerse registrados, indicando las cantidades, el procedimiento de destrucción, el personal responsable y la fecha del procedimiento.
45.2. El/la director/a técnico/a del laboratorio o investigador principal del proyecto de investigación de la universidad o de la institución de investigación comunica con detalle los procedimientos y medios técnicos a emplear, las medidas preventivas y de contingencia, así como el lugar y fecha donde se efectuará el procedimiento de destrucción, a la DIGEMID o las Direcciones de Redes Integradas de Salud, las Direcciones Regionales de Salud o las que hagan sus veces a nivel regional, con un mínimo de diez (10) días hábiles previo al inicio de la destrucción de los residuos de cannabis y sus derivados.
Para el caso de las asociaciones dedicadas a la producción artesanal de derivados de cannabis con cultivo asociativo, el/la encargado/a de la producción artesanal también está obligado a comunicar a la DIGEMID o las Direcciones de Redes Integradas de Salud o las que hagan sus veces a nivel regional, la destrucción de los residuos de cannabis y sus derivados, conforme a las condiciones señaladas en el párrafo anterior.
45.3. Cuando se trate de la destrucción de residuos de cannabis para uso medicinal y terapéutico, la DIGEMID, o las Direcciones de Redes Integradas de Salud, o las Direcciones Regionales de Salud o las que hagan sus veces a nivel regional, según criterio de riesgo, determinan la necesidad de designar a un/una supervisor/a para que intervenga como veedor/a en el procedimiento de destrucción, lo cual es comunicado al administrado. El/la supervisor/a designado/a debe verificar la cantidad de sustancias y/o medicamentos a destruir, presenciar el acto de destrucción, así como levantar el acta respectiva. Luego de designarse al supervisor, las Autoridades antes mencionadas solicitan la participación de representantes del MININTER, MIDAGRI o de otros sectores que se requieran, según sus competencias y atribuciones, quienes intervienen como veedores en el proceso de destrucción.
45.4. Cuando se trate de saldos descartables de productos derivados de cannabis, expirados, deteriorados, contaminados o alterados en su aspecto, que hubieren sido declarados fuera de uso o que hubieren sufrido desmedro o pérdida de su efectividad u otros que tengan observaciones sanitarias, la DIGEMID, o las Direcciones de Redes Integradas de Salud, o las Direcciones Regionales de Salud o las que hagan sus veces a nivel regional, según criterio de riesgo, determinan la necesidad de designar a un supervisor para que intervenga como veedor en el procedimiento de destrucción, lo cual es comunicado al administrado. El/la supervisor/a designado/a debe verificar la cantidad de sustancias y/o medicamentos a destruir, presenciar el acto de destrucción, así como levantar el acta respectiva.
Artículo 46.- Control de calidad
46.1. Los análisis de control de calidad de los productos terminados derivados del cannabis para uso medicinal y terapéutico, se realizan en el Centro Nacional de Control de Calidad (CNCC) del Instituto Nacional de Salud (INS), y en los Laboratorios de la Red Nacional de Laboratorios Oficiales de Control de Calidad.
46.2. Los procedimientos específicos a seguir para la realización de dichos análisis se sujetan a lo dispuesto en las técnicas analíticas farmacopeicas o propias, autorizadas en el registro sanitario por la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM) o lo que establezca el CNCC, cuyos resultados de los análisis son reportados mediante un informe técnico-sanitario.
46.3. Para el control de calidad de productos farmacéuticos derivados de cannabis, el CNCC del INS y los laboratorios de la Red Nacional de Laboratorios Oficiales de Control de Calidad, así como los/las titulares de registro sanitario o los/ las titulares de certificado de registro sanitario, se rigen por lo establecido en las normas correspondientes.
46.4. Para la realización de los análisis de control de calidad por parte de las asociaciones para la producción artesanal con cultivo asociativo de la planta del género cannabis con fines medicinales y terapéuticos, éstas pueden optar por efectuarlas en laboratorios públicos y privados debidamente autorizados por el INS.
46.5. El CNCC del INS y los laboratorios de la Red Nacional de Laboratorios Oficiales de Control de Calidad, a solicitud de las asociaciones para la producción artesanal con cultivo asociativo de la planta del género cannabis con fines medicinales y terapéuticos, brindan el servicio de análisis de control de calidad a realizarse en los productos obtenidos en la producción artesanal; para ello deben implementar las metodologías apropiadas para la identificación de sus componentes, incluyendo las impurezas.
Artículo 47.- Fiscalización sanitaria
47.1. La DIGEMID o las Direcciones de Redes Integradas de Salud o las Direcciones Regionales de Salud o las que hagan sus veces a nivel regional, según corresponda, realizan las acciones de fiscalización sanitaria del cannabis y sus derivados para uso medicinal y terapéutico, a través de inspecciones periódicas a los establecimientos farmacéuticos, universidades e instituciones de investigación, entidades públicas que manejen derivados de cannabis para uso medicinal y terapéutico, y asociaciones para la producción artesanal con cultivo asociativo, a fin de verificar que la producción, importación, distribución, prescripción del cannabis y sus derivados y todo acto relacionado con dichas sustancias y productos se realice exclusivamente con fines medicinales y terapéuticos, así como verificar la conformidad entre la existencia física y los registros correspondientes.
47.2. De evidenciarse durante la fiscalización algún acto contrario a los fines medicinales y terapéuticos del cannabis y sus derivados, se pone este hecho en conocimiento de la instancia pertinente a fin de que proceda a promover la acción penal correspondiente.
Artículo 48.- Inspecciones
48.1. La DIGEMID, publica en su portal web (www.digemid.minsa.gob.pe) las atribuciones de los inspectores.
Las inspecciones se ajustan a lo siguiente:
a. Los/las inspectores/as pueden ingresar durante las horas de funcionamiento, sin necesidad de previa notificación, a cualquiera de los establecimientos o locales de las instituciones de investigación, entidades públicas que manejen derivados de cannabis para uso medicinal y terapéutico, y asociaciones para la producción artesanal con cultivo asociativo. Para la realización de las inspecciones se requiere de dos (02) inspectores como mínimo.
b. Para ingresar al local del establecimiento farmacéutico o entidad pública o universidad o institución de investigación o asociación, los/las inspectores/as deben portar, además de la respectiva credencial que los identifique como tales, una carta de presentación suscrita por el/la titular del órgano responsable de la fiscalización sanitaria, en la que se debe indicar el nombre completo y el número del Documento Nacional de Identidad (DNI) de las personas que hubieren sido designadas para realizar la inspección. Una copia de dicha carta debe quedar en poder del titular de la licencia.
c. Los/las inspectores/as encargados/as de la inspección están facultados para solicitar la exhibición de las copias de los certificados oficiales de importación y comercialización, protocolo de seguridad y registros nacionales de control del cannabis y sus derivados, entre otros documentos, según corresponda.
d. Los/las inspectores/as encargados/as de la inspección están asimismo facultados para revisar o inspeccionar las existencias que hubiere en almacén con el objeto de verificar la veracidad y exactitud de la información contenida en la documentación a que se refiere el literal precedente.
48.2. Una vez concluida la inspección, el/la inspector/a encargado/a levanta el acta correspondiente, la cual es firmada por éste, el/la administrador/a o la persona responsable del establecimiento farmacéutico o entidad pública o universidad o institución de investigación o asociación objeto de inspección, y del director técnico, según corresponda. En caso que estos se nieguen a hacerlo, en el acta se deja constancia del hecho, sin que ello afecte su validez.
El acta de inspección, a su vez, puede disponer además la aplicación de una o más medidas de seguridad contenidas en los literales b), j), k), l), ll), m), y n), del artículo 130 de la Ley Nº 26842, Ley General de Salud.
48.3. Los/las inspectores/as, bajo responsabilidad, elevan el acta correspondiente en un plazo no mayor de cinco (05) días de realizada la inspección, a fin que, mediante Resolución Directoral de la Dirección de Inspección y Certificaciones de la DIGEMID, o, de ser el caso, de la Dirección correspondiente de las Direcciones de Redes Integradas de Salud o las Direcciones Regionales de Salud o las que hagan sus veces a nivel regional, se ratifique, modifique o suspenda la medida adoptada en el acta, sin perjuicio de su aplicación inmediata.
Artículo 49.- Facilidades para la inspección
El/la propietario/a, el/la administrador/a o representante legal del establecimiento farmacéutico o entidad pública o universidad o institución de investigación o asociación objeto de inspección, está obligado a prestar a los/las inspectores/as todas las facilidades que estos requieran para el desarrollo de sus funciones de fiscalización.
Artículo 50.- Reporte de actividades sospechosas
El establecimiento farmacéutico o entidad pública o universidad o institución de investigación o asociación para la producción artesanal con cultivo asociativo que, durante el desarrollo de actividades reguladas mediante el presente Reglamento, tomen conocimiento de operaciones inusuales o conductas sospechosas, o de comercio ilegal, deben comunicarlo a la DIGEMID mediante el formato virtual establecido para tal efecto.
DISPOSICIONES COMPLEMENTARIAS FINALES
Primera.-Registros
El Ministerio de Salud implementa los Registros a los que se hace referencia en el presente Reglamento, en un plazo no mayor de noventa (90) días hábiles, contados a partir de la entrada en vigencia del mismo.
Segunda.- Norma específica para la producción de semilla de cannabis
El MIDAGRI, a través del SENASA, debe aprobar, en un plazo no mayor de ciento ochenta (180) días calendario contados a partir de la entrada en vigencia del presente Reglamento, una norma específica para la producción y comercialización de semilla de cannabis en concordancia con la Ley Nº 27262, Ley General de Semillas, su reglamento y demás normas complementarias, la cual será de cumplimiento obligatorio.
Tercera.- Medidas para facilitar el acceso
El Estado implementa medidas para facilitar el acceso del cannabis y sus derivados, con fines medicinales y terapéuticos, a través de los establecimientos de salud públicos, para garantizar la atención de la demanda de pacientes registrados.
Cuarta.- Incorporación en el PEAS
Incorporar en las prestaciones financiadas por el Plan Esencial de Aseguramiento en Salud (PEAS) y sus planes complementarios las prescripciones médicas para el uso del cannabis y sus derivados con fines medicinales y terapéuticos.
Quinta.- Ingreso o salida de derivados de cannabis para uso medicinal y terapéutico
El ingreso o salida de derivados de cannabis para uso medicinal y terapéutico en poder de viajeros de procedencia nacional o extranjera debe estar amparada con la receta médica correspondiente que acredite su uso. Es responsabilidad del viajero presentar la documentación ante la autoridad aduanera.
Sexta.- Dispensación de preparados farmacéuticos
Para la dispensación de preparados farmacéuticos derivados de cannabis con fines medicinales y terapéuticos, la Institución Prestadora de Servicios de Salud – IPRESS, con código único de IPRESS, que cuente con área de Farmacotecnia, en la Unidad Productora de Servicios de Salud Farmacia, la oficina farmacéutica especializada o la oficina farmacéutica que cuente con área de Farmacotecnia, deben solicitar la licencia de comercialización, para la elaboración de preparados farmacéuticos derivados de cannabis con fines medicinales y terapéuticos, con el fin de atender la prescripción médica, cumpliendo con las normas legales vigentes. En la prescripción se deben especificar claramente las concentraciones de tetrahidrocannabinol (THC) y cannabidiol (CBD), con el fin de determinar la posología.
Séptima.- Modificación del Anexo Nº 1 del presente Reglamento
El Anexo Nº 1 del presente Reglamento está sujeto a modificación en el extremo de origen, denominación y descripción, mediante Resolución Directoral de la DIGEMID.
Octava.- Exoneraciones
Las entidades públicas del MINSA y del MIDAGRI que requieran emplear cannabis para uso medicinal y terapéutico con el objetivo de cumplir con las actividades de evaluación y control están exoneradas de contar con las licencias respectivas.
Novena.- Aplicación supletoria
Para los casos no señalados en el presente Reglamento, se aplican supletoriamente las disposiciones contenidas en la Ley Nº 27262, Ley General de Semillas, y sus modificatorias; el Reglamento de Estupefacientes, Psicotrópicos y otras sustancias sujetas a fiscalización sanitaria, aprobado con Decreto Supremo Nº 023-2001-SA, y sus modificatorias; el Reglamento de Establecimientos Farmacéuticos, aprobado con Decreto Supremo Nº 014-2011-SA, y sus modificatorias; el Reglamento para el Registro, Control y Vigilancia Sanitaria de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios, aprobado con Decreto Supremo Nº 016-2011-SA, y sus modificatorias; el Texto Único Ordenado de la Ley Nº 27444, Ley del Procedimiento Administrativo General, aprobado mediante Decreto Supremo Nº 004-2019-JUS; el Decreto Legislativo Nº 1278, Decreto Legislativo que aprueba la Ley de Gestión Integral de Residuos Sólidos, sus modificatorias, y su Reglamento aprobado por Decreto Supremo Nº 014-2017-MINAM; el Decreto Legislativo Nº 1241, Ley de Fortalecimiento de la Lucha contra el Tráfico Ilícito de Drogas y su Reglamento, la Convención Única de 1961 sobre Estupefacientes, enmendada por el Protocolo de 1972; la Convención de las Naciones Unidas contra el Tráfico Ilícito de Estupefacientes y Sustancias Sicotrópicas, 1988; la Ley Nº 27446, Ley del Sistema Nacional de Evaluación del Impacto Ambiental, sus Reglamentos, y los reglamentos fitosanitarios y demás normas análogas y conexas, siempre que no se contrapongan con lo establecido en la Ley Nº 30681, Ley que regula el uso medicinal y terapéutico del Cannabis y sus derivados, su modificatoria, y el presente Reglamento.
Décima.- Emisión de disposiciones complementarias por parte del MINSA
El Ministerio de Salud emite las disposiciones complementarias que resulten necesarias para la aplicación del presente Reglamento mediante Resolución Ministerial.
Décima Primera.- Excepción
Exceptuar del plazo establecido en el artículo 5 del Reglamento de Estupefacientes. Psicotrópicos y Otras Sustancias sujetas a Fiscalización Sanitaria, aprobado con Decreto Supremo Nº 023-2001-SA, por única vez, hasta el año 2024, a los establecimientos farmacéuticos y entidades públicas que cuenten con la licencia correspondiente a efecto de que comuniquen sus previsiones de derivados de cannabis.
Décima Segunda.- Investigación Científica en Salud
El Instituto Nacional de Salud (INS), en un plazo no mayor de ciento veinte (120) días calendario, contados a partir de la entrada en vigencia del presente Reglamento, mediante Resolución Jefatural, aprueba las normas técnicas necesarias para establecer los parámetros y aspectos relacionados al desarrollo de investigación científica en salud.
Décima Tercera.- Equivalencias de licencias
A efecto de aplicar las disposiciones señaladas en el presente Reglamento a las licencias otorgadas en el marco de lo dispuesto en el Reglamento aprobado por Decreto Supremo Nº 005-2019-SA, deben considerarse las siguientes equivalencias:
Décima Cuarta.- Adecuación de las licencias
Las licencias que se hayan obtenido al amparo de lo dispuesto en el Reglamento aprobado por Decreto Supremo Nº 005-2019-SA, deben adecuarse a las disposiciones mencionadas en el presente Reglamento, según sus equivalencias señaladas en la Décima Cuarta Disposición Complementaria Final del presente Reglamento.
Las referidas licencias, dentro de un (01) año contado a partir de la entrada en vigencia del presente Reglamento, deben presentar ante la Autoridad competente la información y requisitos nuevos que contienen las licencias equivalentes detalladas en la Quinta Disposición Complementaria Transitoria del presente Reglamento. De no realizar las adecuaciones a las licencias otorgadas al amparo del Reglamento aprobado por Decreto Supremo Nº 005-2019-SA, estas son canceladas.
DISPOSICIÓN COMPLEMENTARIA TRANSITORIA
Única.- Regulación transitoria
a) Los procedimientos administrativos iniciados antes de la entrada en vigencia del presente Decreto Supremo se rigen por la normativa anterior hasta su conclusión.
b) No obstante, son aplicables a los procedimientos en trámite, las disposiciones del presente Decreto Supremo que reconozcan derechos o facultades a los administrados frente a la administración.
ANEXO Nº 1
RELACIÓN DE PARTIDAS ARANCELARIAS PARA LA IMPORTACION DE CANNABIS Y SUS DERIVADOS
ANEXO Nº 2
FORMATO DE PLAN DE PRODUCCIÓN AGRÍCOLA PARA LA PRODUCCIÒN DE CANNABIS CON FINES MEDICINALES Y TERAPÉUTICOS
ANEXO Nº 3
REGISTRO DE SIEMBRA DE CANNABIS CON FINES MEDICINALES Y TERAPEUTICOS PARA EL PLAN DE PRODUCCIÓN AGRÍCOLA
ANEXO Nº 4
REGISTRO DE COSECHA DE CANNABIS CON FINES MEDICINALES Y TERAPEUTICOS PARA EL PLAN DE PRODUCCIÓN AGRÍCOLA
ANEXO Nº 5
REGISTRO DE DESTRUCCIÓN Y MANEJO DE RESIDUOS DE CANNABIS CON FINES MEDICINALES Y TERAPEUTICOS PARA EL PLAN DE PRODUCCIÓN AGRÍCOLA
ANEXO Nº 6
LISTADO DE INSUMOS UTILIZADOS EN LA PRODUCCIÓN DE CANNABIS CON FINES MEDICINALES Y TERAPEUTICOS PARA EL PLAN DE PRODUCCIÓN AGRÍCOLA
ANEXO Nº 7
ESTRUCTURA Y COMPONENTES MÍNIMOS DE LAS PROPUESTAS DE PROYECTOS DE INVESTIGACIÓN
1. Nombre del Proyecto de Investigación.
2. Fecha de inicio / Fecha de término del Proyecto de Investigación.
3. Responsable del Proyecto de Investigación. (Mencionar la persona jurídica o natural titular o responsable del proyecto; así como de los involucrados o colaboradores en la investigación).
4. Tipo de proyecto o estudio. (Precisar la línea de investigación: Biodiversidad, mejoramiento genético, Biotecnología, Fisiología, Química y procesos industriales, Sistemática, etc.).
5. Lugar de procedencia de material genético a utilizarse en la investigación.
6. Lugar donde se realizarán las actividades de investigación.
7. Antecedentes de la Investigación.
6.1 Desarrollar los avances existentes sobre el tema materia de estudio, que contribuya al mejor conocimiento de la situación del material genético a investigar.
6.2 Describir si existiese algún uso asociado al material genético en el marco de la investigación a realizar, especificando si hará uso del mismo, de ser el caso.
8. Justificación e importancia de la investigación.
9. Objetivos y fines de la investigación, relacionados.
10. Metodología (Métodos y técnicas de forma detallada, precisando la entidad/institución de investigación dónde se realizará cada actividad).
11. Relación del material genético de las muestras por género y/o especie (indicando la cantidad, tipo de las muestras y el lugar de procedencia).
12. Nombres y apellidos completos del Investigador Principal o Responsable y de su grupo de trabajo, según Anexo Nº 9, adjuntando su currículo descriptivo actualizado, respectivamente.
13. Cronograma de trabajo detallado, indicado fechas referenciales (Deben considerarse las etapas y actividades a desarrollar en la investigación hasta la presentación del Informe final).
14. Referencias bibliográficas.
![Cada destitución posee existencia independiente, salvo que se trate del mismo hecho y fundamento, en cuyo caso impera el principio ne bis in idem (Juez destituido alegó vulneración al ejercicio de la autodefensa técnica) (caso César Hinostroza) [Apelación 185-2024, Corte Suprema, f. j. 11]](https://img.lpderecho.pe/wp-content/uploads/2024/04/balanza-abogado-juez-justicia-defensa-LPDerecho-218x150.jpg)


![El método Widmark no determina de manera absoluta el estado de conciencia de una persona después de haber consumido licor; siendo importante, para determinar el real estado, evaluar el comportamiento de la persona [Casación 2199-2022, Puno, f. j. 3.4]](https://img.lpderecho.pe/wp-content/uploads/2024/05/Pericia-de-alcoholemia-LPDerechoPericia-de_-218x150.jpg)
![Martín Vizcarra: TC declara infundada demanda de amparo contra su inhabilitación política [Expediente 01716-2024-PA/TC]](https://img.lpderecho.pe/wp-content/uploads/2025/06/VIZCARRA-TC-LPDERECHO-218x150.jpg)
![Se puede hacer un control oficioso de un acto ineficaz (apoderado vendió bien del poderdante cuando este ya había muerto) [Expediente 00211-2018-0-0905-JR-CI-01]](https://img.lpderecho.pe/wp-content/uploads/2023/01/testamento-firma-sucesion-bienes-matrimonio-casa-civil-contrato-LPDerecho-218x150.png)
![Ley Orgánica del Registro Nacional de Identificación y Estado Civil (Ley 26497) [actualizada 2025]](https://img.lpderecho.pe/wp-content/uploads/2025/05/Ley-organica-del-registro-nacional-de-identificacion-y-estado-civil1-LPDERECHO-218x150.jpg)











![¿Qué son los esponsales o promesa de matrimonio? Bien explicado [ACTUALIZADO 2025] Los esponsales en el Código Civil peruano](https://img.lpderecho.pe/wp-content/uploads/2021/05/Los-esponsales-en-el-Codigo-Civil-peruano-LP-218x150.png)

![[VIVO] Clase gratuita sobre régimen de visitas. Llena el formulario para recibir las diapositivas](https://img.lpderecho.pe/wp-content/uploads/2025/06/BANNER-CLEIDY-BUTRON-LPDERECHO-218x150.jpg)
![Invalidez del matrimonio: ¿cuáles son las causas para su nulidad o anulabilidad? [ACTUALIZADO 2025] La invalidez del matrimonio en el Código Civil peruano](https://img.lpderecho.pe/wp-content/uploads/2021/04/La-invalidez-del-matrimonio-en-el-Codigo-Civil-peruano-LP-218x150.png)
![Sunafil puede sancionar la desnaturalización de contratos incluso si ya terminó el vínculo laboral [Resolución 0484-2025-Sunafil/TFL-Primera Sala]](https://img.lpderecho.pe/wp-content/uploads/2024/03/sunafil-fachada-LPDerecho-218x150.jpg)



![Variar el título de imputación de cómplice primario a autor en la sentencia de vista altera todo lo discutido a lo largo del proceso, sin permitir que el favorecido modifique su estrategia de defensa, situación que afecta, de forma flagrante su derecho de defensa y el principio de correlación entre lo acusado y lo condenado [Exp. 02418-2023-PHC/TC]](https://img.lpderecho.pe/wp-content/uploads/2024/04/mazo-justicia-juez-jueza-defensa-civil-penal-juicio-LPDerecho-218x150.jpg)
![La Constitución no puede ser objeto de una evaluación de validez material porque no existe una norma superior sobre ella que determine sus contenidos mínimos [Exp. 014-2003-AI/TC, f. j. 17]](https://img.lpderecho.pe/wp-content/uploads/2023/01/Logo-LP-con-fondo-guinda-LPDERECHO-218x150.png)


![Aprueban TUPA del Indecopi [Decreto Supremo 088-2025-PCM]](https://img.lpderecho.pe/wp-content/uploads/2025/02/indecopi-fachada-colegio-LPDerecho-218x150.jpg)
![Destituyen a jueza de paz por resolver un proceso de tenencia de menores e intervenir en transferencias de propiedad y posesión [Investigación Definitiva 153-2021-Cusco]](https://img.lpderecho.pe/wp-content/uploads/2024/12/Portada-web-jueza-prueba-grafotecnica-lp-derecho-218x150.jpg)
![Reglamento de la Ley 30364 (Decreto Supremo 009-2016-MIMP) [actualizado 2025]](https://img.lpderecho.pe/wp-content/uploads/2024/07/Reglamento-de-la-Ley-30364-LPDERECHO-218x150.jpg)

![Código Procesal Penal peruano [actualizado 2025]](https://img.lpderecho.pe/wp-content/uploads/2024/02/VENTA-CODIGO-PENAL-BANNER-POST-TAPA-DURA-LPDERECHO-218x150.jpg)
![Reglamento sobre encuestas electorales durante los procesos electorales [Resolución 0107-2025-JNE]](https://img.lpderecho.pe/wp-content/uploads/2025/05/REGLAMENTO-ENCUESTAS-ELECTORALES-LPDERECHO-1-218x150.jpg)
![Diseño de la cédula de sufragio para la Consulta Popular de Revocatoria del Mandato de Autoridades Municipales 2025 [Resolución Jefatural 000031-2025-JN/ONPE]](https://img.lpderecho.pe/wp-content/uploads/2025/05/DISENO-CELULA-SUFRAGIO-REVOCATORIA-LPDERECHO-218x150.jpg)





![[VIDEO] Juez propone que todos los delitos se tramiten en unidades de flagrancia, sin excepción](https://img.lpderecho.pe/wp-content/uploads/2025/05/DELITOS-PLANTEA-TABOA-LPDERECHO-218x150.jpg)
![[VIDEO] Hay jueces que rechazan cautelares porque «el caso es complejo», advierte Giovanni Priori en LP](https://img.lpderecho.pe/wp-content/uploads/2025/05/JUECES-RECHAZAN-CAUTELARES-GIOVANNI-LPDERECHO-218x150.jpg)
![[VIDEO] Pedro Castillo podría buscar asilo político si enfrenta el juicio en libertad, advierten Benji Espinoza y Elio Riera](https://img.lpderecho.pe/wp-content/uploads/2025/05/PEDRO-CASTILLO-ASILO-ABOGADOS-LPDERECHO-218x150.jpg)





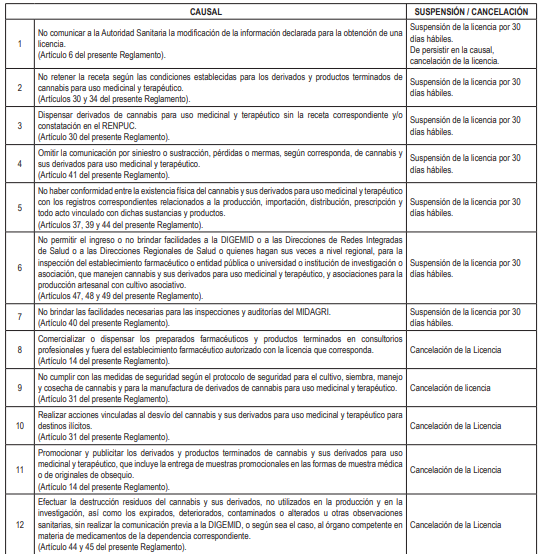
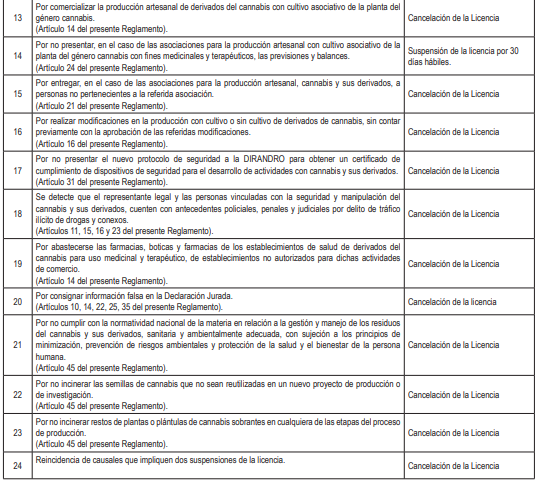
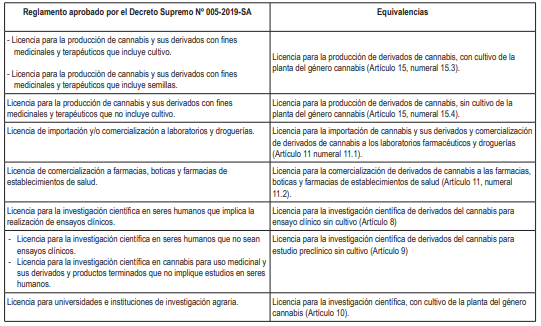
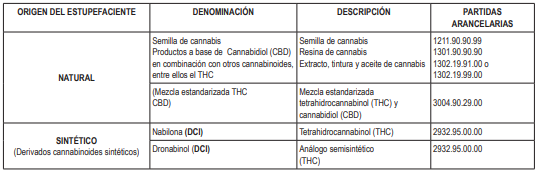
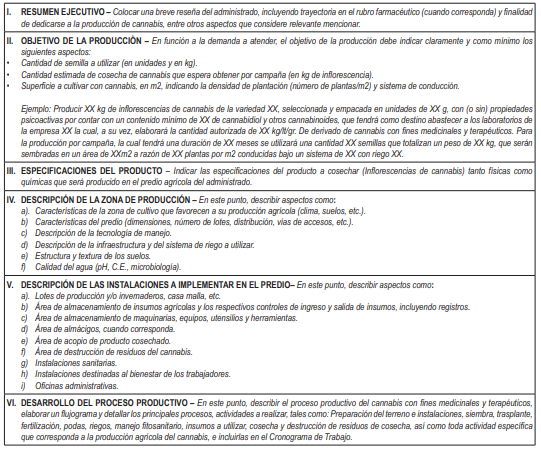

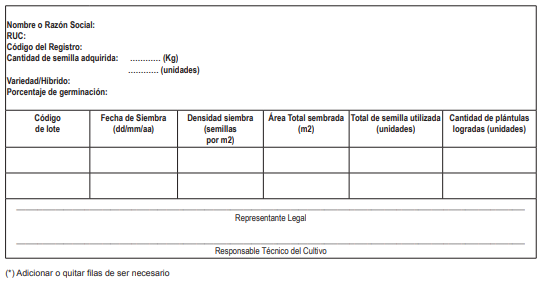
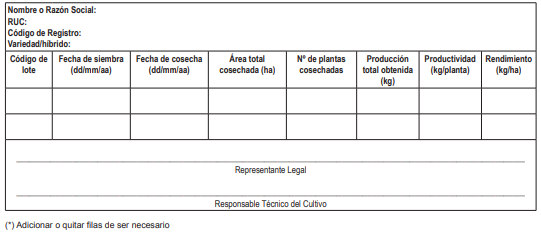
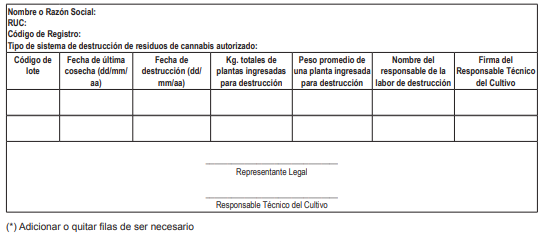
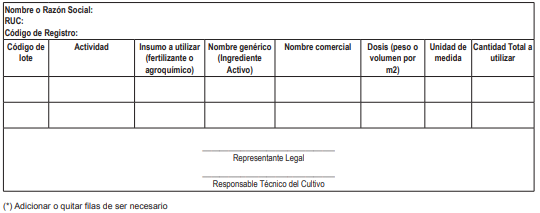

![Destituyen a juez de paz que emitió un acta de constatación de posesión de un terreno a favor de su cuñada [Investigación Definitiva 10-2023-Sullana]](https://img.lpderecho.pe/wp-content/uploads/2024/11/Portada-web-juez-resolucion-ocultar-218x150.jpg)
![Reinfo: prorrogan plazo de vigencia por última vez y disponen su cierre definitivo [Decreto Supremo 012-2025-EM]](https://img.lpderecho.pe/wp-content/uploads/2025/06/mineros-mineria-peru-LPDerecho-218x150.jpg)
![Código Penal peruano [actualizado 2025]](https://img.lpderecho.pe/wp-content/uploads/2024/05/VENTA-CODIGO-PENAL-LPDERECHO-324x160.jpg)
![Código Civil peruano [actualizado 2025]](https://img.lpderecho.pe/wp-content/uploads/2024/05/VENTA-OFICIAL-CODIGO-CIVIL-2024-LPDERECHO-100x70.jpg)
![Abonar en total 800 soles a través de pequeñas transferencias por Yape (de entre 5 y 50 soles) como propinas para la compra de hamburguesas, entre otros gastos no esenciales, no constituye pago de alimentos [Exp. 6839-2023-25]](https://img.lpderecho.pe/wp-content/uploads/2025/04/Giammpol-Taboada-Pilco-LPDerecho-100x70.png)
![Código Procesal Penal peruano [actualizado 2025]](https://img.lpderecho.pe/wp-content/uploads/2024/02/VENTA-CODIGO-PENAL-BANNER-POST-TAPA-DURA-LPDERECHO-100x70.jpg)

![Cada destitución posee existencia independiente, salvo que se trate del mismo hecho y fundamento, en cuyo caso impera el principio ne bis in idem (Juez destituido alegó vulneración al ejercicio de la autodefensa técnica) (caso César Hinostroza) [Apelación 185-2024, Corte Suprema, f. j. 11]](https://img.lpderecho.pe/wp-content/uploads/2024/04/balanza-abogado-juez-justicia-defensa-LPDerecho-324x160.jpg)
![¿Qué son los esponsales o promesa de matrimonio? Bien explicado [ACTUALIZADO 2025] Los esponsales en el Código Civil peruano](https://img.lpderecho.pe/wp-content/uploads/2021/05/Los-esponsales-en-el-Codigo-Civil-peruano-LP-100x70.png)


![[VIVO] Clase gratuita sobre régimen de visitas. Llena el formulario para recibir las diapositivas](https://img.lpderecho.pe/wp-content/uploads/2025/06/BANNER-CLEIDY-BUTRON-LPDERECHO-100x70.jpg)
![Código Penal peruano [actualizado 2025]](https://img.lpderecho.pe/wp-content/uploads/2024/05/VENTA-CODIGO-PENAL-LPDERECHO-100x70.jpg)
![Cada destitución posee existencia independiente, salvo que se trate del mismo hecho y fundamento, en cuyo caso impera el principio ne bis in idem (Juez destituido alegó vulneración al ejercicio de la autodefensa técnica) (caso César Hinostroza) [Apelación 185-2024, Corte Suprema, f. j. 11]](https://img.lpderecho.pe/wp-content/uploads/2024/04/balanza-abogado-juez-justicia-defensa-LPDerecho-100x70.jpg)




![ANC PJ: directiva para recibir denuncias anónimas contra jueces y auxiliares jurisdiccionales [Resolución 115-2025-JN-ANC-PJ]](https://img.lpderecho.pe/wp-content/uploads/2025/05/PODER-JUDICIAL-ANC-LPDRECHO-324x160.jpg)