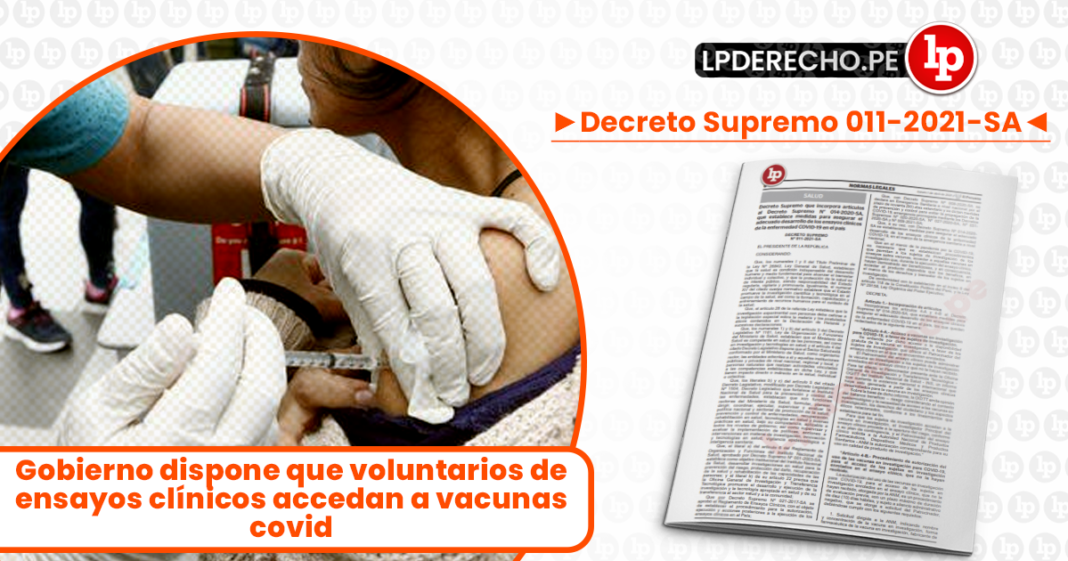
El Decreto Supremo 011-2021-SA fue publicado en el diario oficial El Peruano en la edición extraordinaria del 1 de abril de 2021. El decreto autoriza que voluntarios de ensayos clínicos accedan a vacunas contra el covid-19.
Decreto Supremo que incorpora artículos al Decreto Supremo N° 014-2020-SA, que establece medidas para asegurar el adecuado desarrollo de los ensayos clínicos de la enfermedad COVID-19 en el país
DECRETO SUPREMO Nº 011-2021-SA
EL PRESIDENTE DE LA REPÚBLICA
CONSIDERANDO:
Que, los numerales I y II del Título Preliminar de la Ley Nº 26842, Ley General de Salud, establecen que la salud es condición indispensable del desarrollo humano y medio fundamental para alcanzar el bienestar individual y colectivo, y que la protección de la salud es de interés público, siendo responsabilidad del Estado regularla, vigilarla y promoverla. Igualmente, el numeral XV del citado cuerpo normativo establece que el Estado promueve la investigación científica y tecnológica en el campo de la salud, así como la formación, capacitación y entrenamiento de recursos humanos para el cuidado de la salud;
Que, el artículo 28 de la referida Ley establece que la investigación experimental con personas debe ceñirse a la legislación especial sobre la materia y los postulados éticos contenidos en la Declaración de Helsinki y sucesivas declaraciones;
Que, los numerales 1) y 9) del artículo 3 del Decreto Legislativo Nº 1161, Ley de Organización y Funciones del Ministerio de Salud, establecen que el Ministerio de Salud es competente en salud de las personas, así como en investigación y tecnologías en salud; y el artículo 4 del citado Decreto Legislativo dispone que el Sector Salud está conformado por el Ministerio de Salud, como organismo rector, las entidades adscritas a él y aquellas instituciones públicas y privadas de nivel nacional, regional y local, y personas naturales que realizan actividades vinculadas a las competencias establecidas en dicha Ley, y que tienen impacto directo o indirecto en la salud, individual o colectiva;
Que, los literales b) y c) del artículo 5 del citado Decreto Legislativo, modificado por Decreto Legislativo Nº 1504, Decreto Legislativo que fortalece al Instituto Nacional de Salud para la prevención y control de las enfermedades, establecen que son funciones rectoras del Ministerio de Salud, formular, planear, dirigir, coordinar, ejecutar, supervisar y evaluar la política nacional y sectorial de promoción de la salud, prevención y control de enfermedades, recuperación, rehabilitación en salud, tecnologías en salud y buenas prácticas en salud, bajo su competencia, aplicable a todos los niveles de gobierno; así como supervisar y evaluar la implementación de políticas, acciones e intervenciones en materia de investigación, innovación y tecnologías en salud, vigilancia epidemiológica e inteligencia sanitaria;
Que, el literal a) del artículo 6 del Reglamento de Organización y Funciones del Instituto Nacional de Salud, aprobado por Decreto Supremo Nº 001-2003-SA, establece como objetivo institucional del Instituto Nacional de Salud, desarrollar investigaciones en salud para la prevención del riesgo, protección del daño, recuperación de la salud y rehabilitación de las capacidades de las personas; y el literal b) de su artículo 22 precisa que la Oficina General de Investigación y Transferencia Tecnológica promueve el desarrollo y ejecución de la investigación y la tecnología apropiada en salud y de su transferencia al sector salud y a la comunidad;
Que por Decreto Supremo Nº 021-2017-SA se aprobó el Reglamento de Ensayos Clínicos, con el objeto de establecer el procedimiento para la autorización, ejecución y acciones posteriores a la ejecución de los ensayos clínicos en el País;
Que, con Decreto Supremo Nº 008-2020-SA se declara en Emergencia Sanitaria a nivel nacional por el plazo de noventa (90) días calendario y se dictan medidas de prevención y control para evitar la propagación de la COVID-19, emergencia prorrogada mediante los Decretos Supremos Nº 020-2020-SA, Nº 027-2020-SA, Nº 031-2020-SA y Nº 009-2021-SA;
Que, a su vez, con Decreto Supremo Nº 014-2020-SA se establecieron medidas para asegurar el adecuado desarrollo de los ensayos clínicos de la enfermedad COVID-19, en el marco de la emergencia sanitaria a nivel nacional;
Que en el marco de la pandemia por la COVID-19, es necesario que se establezcan procedimientos que permitan a los sujetos de investigación de los ensayos sobre vacunas, acceder a aquellas vacunas en investigación que, durante la ejecución del ensayo clínico, hayan demostrado ser beneficiosas, y en consecuencia, acceder al producto disponible que los beneficia, en el marco de los derechos y bienestar de los sujetos en investigación;
De conformidad con lo establecido en el inciso 8 del artículo 118 de la Constitución Política del Perú, y la Ley Nº 29158, Ley Orgánica del Poder Ejecutivo;
DECRETA:
Artículo 1.- Incorporación de artículos
Incorpóranse los artículos 4-A y 4-B al Decreto Supremo Nº 014-2020-SA, que establece medidas para asegurar el adecuado desarrollo de los ensayos clínicos de la enfermedad COVID-19 en el país, los que quedan redactados de la siguiente manera:
“Artículo 4-A.- Acceso a vacunas en investigación para COVID-19, a favor de sujetos de investigación.
Se entiende por dicho acceso a la disponibilidad gratuita de la vacuna en investigación, a favor de los sujetos de investigación que ofrece el Patrocinador del ensayo clínico en el que se encuentran enrolados.
El Patrocinador del ensayo clínico puede administrar la vacuna en investigación a los sujetos de investigación enrolados en el ensayo clínico y que no la hayan recibido. Para tal efecto, el Patrocinador presenta ante la Oficina General de Investigación y Transferencia Tecnológica – OGITT del Instituto Nacional de Salud – INS, un informe que sustente la evidencia nacional e internacional que haya sido generada a partir de los ensayos clínicos desarrollados para la vacuna en investigación.
Sobre la base de dicho informe, la OGITT emite opinión del balance beneficio – riesgo considerando el contexto epidemiológico y la necesidad de acceso a las vacunas en investigación, los derechos del ciudadano y los aspectos éticos relacionados, conforme a los lineamientos que establezca para tal fin.
Para que los sujetos de investigación accedan a la vacuna en investigación, el Investigador Principal del ensayo clínico procede a la apertura del ciego, conforme a su plan de contingencia, y el Patrocinador del ensayo clínico solicita a la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios – ANM la autorización correspondiente para su uso en calidad de producto de investigación.”
“Artículo 4-B.- Procedimiento de autorización del uso de las vacunas en investigación para COVID-19, para el acceso de los sujetos en investigación enrolados en el ensayo clínico, que no la hayan recibido.
La autorización del uso de las vacunas en investigación para COVID-19, para el acceso de los sujetos en investigación enrolados en el ensayo clínico, que no la hayan recibido, otorgada por la ANM, es un procedimiento de evaluación previa, con un plazo máximo de duración de diez (10) días hábiles, y sujeto a silencio administrativo negativo, que se otorga a solicitud del Patrocinador, debiéndose cumplir con los siguientes requisitos:
1. Solicitud dirigida a la ANM, indicando nombre y concentración de la vacuna en investigación, forma farmacéutica de la vacuna en investigación, fabricante de la vacuna en investigación, país de origen de la vacuna en investigación, cantidad total a usar de la vacuna en investigación, cantidad total a importar de la vacuna en investigación, tiempo planificado para la administración de las vacunas en investigación, el número de Informe con la opinión favorable respecto al balance beneficio – riesgo para acceso a la vacuna en investigación, remitido por la OGITT del INS, así como el número de la Resolución Directoral de autorización del ensayo clínico.
2. Copia del consentimiento informado que se aplica al momento de administrar la vacuna en investigación y la carta mediante la cual el Comité Nacional Transitorio de Ética en Investigación – CNTEI aprueba el consentimiento informado. Dicho consentimiento informado debe considerar la información de seguridad actualizada para la administración de la vacuna en investigación.
3. Declaración Jurada conjunta del Patrocinador e Investigador Principal, en la que declaren:
a. Haber informado a todos los sujetos de investigación que no recibieron la vacuna que pueden acceder a ella.
b. La relación de sujetos de investigación que recibirán la vacuna, identificando nombres, apellidos, documento de identidad y código del sujeto en investigación en el ensayo clinico.
c. Seguir ejecutando el seguimiento a todos los sujetos de investigación hasta que concluya el ensayo clínico correspondiente.
d. Que todos los sujetos conocen el consentimiento informado aprobado por el CNTEI.
4. Copia de la conformidad para la aplicación de la vacuna en investigación, emitida por el responsable del Centro de Investigación autorizado donde ésta será inoculada.
5. Copia del Manual del investigador actualizado, según Anexo 02 del Reglamento de Ensayos Clínicos aprobado con Decreto Supremo Nº 021-2017-SA.
La autorización de uso de las vacunas en investigación para COVID-19, para el acceso de los sujetos en investigación, permite al patrocinador la importación de las referidas vacunas.
Para el destino final de las vacunas en investigación no utilizadas y/o devueltas, aplica lo dispuesto en el artículo 96 y la excepción del literal b) del artículo 97 del Reglamento de Ensayos Clínicos aprobado con Decreto Supremo Nº 021-2017-SA. Además, se exceptúa de la destrucción de las vacunas en investigación no utilizadas y/o devueltas a las donadas para su uso al Ministerio de Salud.
El patrocinador remite los consentimientos informados a la ANM, debidamente suscritos por el sujeto de investigación y el investigador principal o un coinvestigador, hasta treinta (30) días calendario posteriores al tiempo planificado para la administración de las vacunas en investigación.”
Artículo 2.- Refrendo
El presente Decreto Supremo es refrendado por el Ministro de Salud.
Dado en la Casa de Gobierno, en Lima, al primer día del mes de abril del año dos mil veintiuno.
FRANCISCO RAFAEL SAGASTI HOCHHAUSLER
Presidente de la República
ÓSCAR UGARTE UBILLUZ
Ministro de Salud
![Lavado de activos: No es un delito de sospecha, exige la concurrencia de todos los elementos típicos y no goza de un régimen probatorio relajado [Casación 2921-2022, Tacna, f. j. 3]](https://img.lpderecho.pe/wp-content/uploads/2024/04/mazo-juez-defensa-delito-civil-penal-jueza-justicia-acusacion-LPDerecho-218x150.jpg)
![Curso gratuito «Estudio de casos JNJ» [Inicio: 17 JULIO]](https://img.lpderecho.pe/wp-content/uploads/2023/01/Logo-LP-con-fondo-rojo-LPDERECHO-218x150.png)
![Disminuir la velocidad de su vehículo por breves segundos con la finalidad de ingresar al carril derecho, no configura un riesgo prohibido al no encuadrar en ninguna infracción de tránsito imputada, por lo que no cumple la estructura típica del delito de lesiones culposas agravadas por infracción de reglas de tránsito [RN 246-2025, Lima, ff. jj. 26, 27]](https://img.lpderecho.pe/wp-content/uploads/2025/07/JUEZ-FIRMANDO-DOCUMENTO-LPDERECHO-218x150.jpg)

![TC declara inconstitucional ordenanzas municipales que permiten multar y remolcar autos mal estacionados [Expediente 00002-2023-PI/TC]](https://img.lpderecho.pe/wp-content/uploads/2025/07/GRUA-AUTO-DEPOSITO-LPDERECHO-218x150.jpg)
![Aunque el «cerdo» es un animal de granja, no está excluido de su calificación como un «animal vertebrado doméstico», por lo que se encuentra comprendido dentro del ámbito de protección frente a actos de crueldad (Ley 30407) [Casación 1950-2024, Ica, f. j. 4]](https://img.lpderecho.pe/wp-content/uploads/2025/07/CERDITO-CORTE-SUPREMA-LPDERECHO-218x150.jpg)
![¿Constituye delito afirmar «Viva el presidente Gonzalo, el único que hizo temblar al Congreso»? La apología al terrorismo no exige que se haga «referencia mínima a los actos subversivos» cometidos por el condenado por terrorismo [RN 387-2024, Nacional, f. j. 7.4]](https://img.lpderecho.pe/wp-content/uploads/2024/09/facebook-condena-sujeto-suplantado-LPDERECHO-218x150.jpg)
![Ley Orgánica del Registro Nacional de Identificación y Estado Civil (Ley 26497) [actualizada 2025]](https://img.lpderecho.pe/wp-content/uploads/2025/05/Ley-organica-del-registro-nacional-de-identificacion-y-estado-civil1-LPDERECHO-218x150.jpg)











![¿Qué es el mejor derecho de propiedad? [ACTUALIZADO 2025]](https://img.lpderecho.pe/wp-content/uploads/2021/07/Que-es-el-mejor-derecho-de-propiedad-LPDerecho-218x150.png)
![¿Qué es la «acción reivindicatoria» y cuáles son sus requisitos? (artículo 927 del Código Civil) [ACTUALIZADO 2025]](https://img.lpderecho.pe/wp-content/uploads/2020/08/Acci%C3%B3n-reivincatoria-LP-218x150.png)

![¿Puede una negociación colectiva tener más de un producto negocial? [Informe Técnico 001191-2025-Servir-GPGSC]](https://img.lpderecho.pe/wp-content/uploads/2024/06/servir4-LPDERECHO-218x150.jpg)




![Un adecuado y transparente proceso de nombramiento y selección de los miembros del Tribunal Constitucional constituye requisito indispensable a fin de garantizar la independencia y la autonomía de este órgano supremo (caso Disolución del Congreso) [Exp. 0006-2019-CC/TC, f. j. 166]](https://img.lpderecho.pe/wp-content/uploads/2023/05/tribunal-constitucional-tc-precedente-LPDerecho-218x150.png)

![Lineamientos para presentar escritos en mesas de partes de las Salas Supremas [Resolución Administrativa 000228-2025-CE-PJ]](https://img.lpderecho.pe/wp-content/uploads/2025/07/MESAS-PARTES-SALAS-SUPREMAS-LPDERECHO-218x150.jpg)

![Reglamento de la Ley 30364 (Decreto Supremo 009-2016-MIMP) [actualizado 2025]](https://img.lpderecho.pe/wp-content/uploads/2024/07/Reglamento-de-la-Ley-30364-LPDERECHO-218x150.jpg)

![Código Procesal Penal peruano [actualizado 2025]](https://img.lpderecho.pe/wp-content/uploads/2024/02/VENTA-CODIGO-PENAL-BANNER-POST-TAPA-DURA-LPDERECHO-218x150.jpg)
![Reglamento sobre encuestas electorales durante los procesos electorales [Resolución 0107-2025-JNE]](https://img.lpderecho.pe/wp-content/uploads/2025/05/REGLAMENTO-ENCUESTAS-ELECTORALES-LPDERECHO-1-218x150.jpg)
![Diseño de la cédula de sufragio para la Consulta Popular de Revocatoria del Mandato de Autoridades Municipales 2025 [Resolución Jefatural 000031-2025-JN/ONPE]](https://img.lpderecho.pe/wp-content/uploads/2025/05/DISENO-CELULA-SUFRAGIO-REVOCATORIA-LPDERECHO-218x150.jpg)





![[VIDEO] Juez propone que todos los delitos se tramiten en unidades de flagrancia, sin excepción](https://img.lpderecho.pe/wp-content/uploads/2025/05/DELITOS-PLANTEA-TABOA-LPDERECHO-218x150.jpg)
![[VIDEO] Hay jueces que rechazan cautelares porque «el caso es complejo», advierte Giovanni Priori en LP](https://img.lpderecho.pe/wp-content/uploads/2025/05/JUECES-RECHAZAN-CAUTELARES-GIOVANNI-LPDERECHO-218x150.jpg)
![[VIDEO] Pedro Castillo podría buscar asilo político si enfrenta el juicio en libertad, advierten Benji Espinoza y Elio Riera](https://img.lpderecho.pe/wp-content/uploads/2025/05/PEDRO-CASTILLO-ASILO-ABOGADOS-LPDERECHO-218x150.jpg)



![«Salud mental en tu cole»: aprueban plan de salud mental en instituciones educativas [Decreto Supremo 012-2025-SA]](https://img.lpderecho.pe/wp-content/uploads/2023/03/escolares-primaria-colegio-salon-clases-educacion-LPDerecho-218x150.png)

![¡Atención, sector público! Aprueban requisitos para la entrega del aguinaldo por Fiestas Patrias [DS 139-2025-EF] Dinero](https://img.lpderecho.pe/wp-content/uploads/2021/11/dinero-sueldo-soles-gratificacion-aguinaldo-bono-cts-normas-legales-LPDerecho-324x160.png)
![El art. 54 del CPP asume implícitamente que durante la audiencia de juicio oral no cabe la recusación, ya que solo regula que si luego de iniciar la audiencia el juez advierte (por sí o por intermedio de las partes) un hecho constitutivo de inhibición deberá declararla de oficio [Recusación 7-2025, Suprema, f. j. 3]](https://img.lpderecho.pe/wp-content/uploads/2024/03/Betssy-Chavez-Poder-Judicial-LPDerecho-100x70.jpg)
![Código Penal peruano [actualizado 2025]](https://img.lpderecho.pe/wp-content/uploads/2024/05/VENTA-CODIGO-PENAL-LPDERECHO-100x70.jpg)
![Multan a Listo con más de S/220 000 por revisar pertenencias de cliente sin causa justificada [Res. Final 1018-2025/CC2]](https://img.lpderecho.pe/wp-content/uploads/2025/07/caso-listo-discriminacion-revision-injustificada-pertenencias-cliente-LPDerecho-100x70.jpg)
![Código Procesal Penal peruano [actualizado 2025]](https://img.lpderecho.pe/wp-content/uploads/2024/02/VENTA-CODIGO-PENAL-BANNER-POST-TAPA-DURA-LPDERECHO-100x70.jpg)
![Lavado de activos: No es un delito de sospecha, exige la concurrencia de todos los elementos típicos y no goza de un régimen probatorio relajado [Casación 2921-2022, Tacna, f. j. 3]](https://img.lpderecho.pe/wp-content/uploads/2024/04/mazo-juez-defensa-delito-civil-penal-jueza-justicia-acusacion-LPDerecho-324x160.jpg)
![Curso gratuito «Estudio de casos JNJ» [Inicio: 17 JULIO]](https://img.lpderecho.pe/wp-content/uploads/2023/01/Logo-LP-con-fondo-rojo-LPDERECHO-100x70.png)
![¿Qué es el mejor derecho de propiedad? [ACTUALIZADO 2025]](https://img.lpderecho.pe/wp-content/uploads/2021/07/Que-es-el-mejor-derecho-de-propiedad-LPDerecho-100x70.png)
![¿Puede una negociación colectiva tener más de un producto negocial? [Informe Técnico 001191-2025-Servir-GPGSC]](https://img.lpderecho.pe/wp-content/uploads/2024/06/servir4-LPDERECHO-100x70.jpg)

![¡Atención, sector público! Aprueban requisitos para la entrega del aguinaldo por Fiestas Patrias [DS 139-2025-EF] Dinero](https://img.lpderecho.pe/wp-content/uploads/2021/11/dinero-sueldo-soles-gratificacion-aguinaldo-bono-cts-normas-legales-LPDerecho-100x70.png)
![Lavado de activos: No es un delito de sospecha, exige la concurrencia de todos los elementos típicos y no goza de un régimen probatorio relajado [Casación 2921-2022, Tacna, f. j. 3]](https://img.lpderecho.pe/wp-content/uploads/2024/04/mazo-juez-defensa-delito-civil-penal-jueza-justicia-acusacion-LPDerecho-100x70.jpg)




