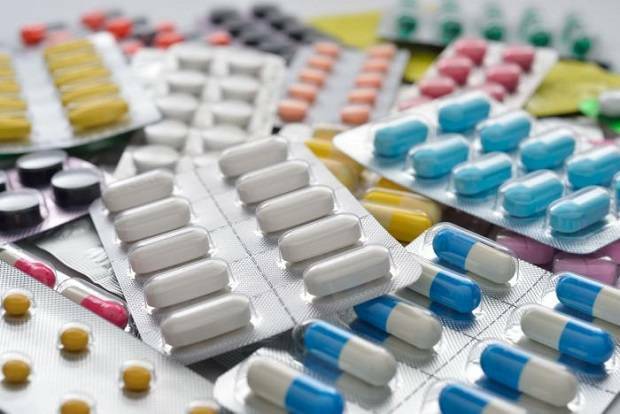
Mediante el Decreto Supremo 004-2025-SA, el Minsa establece disposiciones clave sobre el registro sanitario de productos farmacéuticos destinados al diagnóstico y tratamiento de enfermedades raras y huérfanas. Esta normativa prioriza la atención de estas condiciones como cuestión de interés nacional y facilita la circulación de medicamentos y tratamientos médicos en el país.
El decreto tiene como objetivo principal establecer las disposiciones necesarias para el registro de estos productos farmacéuticos, eliminando barreras burocráticas y permitiendo su acceso más ágil en el sistema de salud peruano.
En concreto, los productos farmacéuticos que cuenten con un registro sanitario de países de alta vigilancia sanitaria serán automáticamente considerados para el registro en Perú, siempre que se presente la documentación pertinente.
Dentro de sus artículos, el decreto especifica que el registro sanitario será de vigencia temporal y renovable cada cinco años, lo que permitirá un seguimiento continuo de la eficacia y seguridad de estos medicamentos.
Además, se establece que los titulares de los registros deberán presentar información periódica sobre la seguridad y eficacia de los productos farmacéuticos, contribuyendo a un control más riguroso por parte de la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM).
La normativa también menciona requisitos claros para la inscripción o reinscripción de estos productos, incluyendo la presentación de una solicitud que contenga todos los datos necesarios y una declaración jurada. Se contempla un mecanismo de vigilancia para asegurar que los productos en el mercado cumplen con los estándares de calidad exigidos.
El presente Decreto Supremo entrará en vigencia a los seis meses de su publicación.
Decreto Supremo que regula lo dispuesto en el Artículo 9 de la Ley N° 29698, Ley que declara de interés nacional y preferente atención el tratamiento de personas que padecen enfermedades raras o huérfanas, modificada por la Ley N° 31738
decreto supremo N° 004-2025-SA
LA PRESIDENTA DE LA REPÚBLICA
CONSIDERANDO:
Que, los numerales I y II del Título Preliminar de la Ley N° 26842, Ley General de Salud, disponen que la salud es condición indispensable del desarrollo humano y medio fundamental para alcanzar el bienestar individual y colectivo, y que es responsabilidad del Estado regularla, vigilarla y promoverla;
Que, el numeral 6) del artículo 3 del Decreto Legislativo N° 1161, Ley de Organización y Funciones del Ministerio de Salud, establece que el Ministerio de Salud es competente en productos farmacéuticos y sanitarios, dispositivos médicos y establecimientos farmacéuticos, y su artículo 4 dispone que el Sector Salud está conformado por el Ministerio de Salud, como organismo rector, las entidades adscritas a él y aquellas instituciones públicas y privadas de nivel nacional, regional y local, y personas naturales que realizan actividades vinculadas a las competencias establecidas en dicha Ley, y que tienen impacto directo o indirecto en la salud, individual o colectiva;
Que, los literales b) y h) del artículo 5 del Decreto Legislativo N° 1161, modificado por el Decreto Legislativo N° 1504, Decreto Legislativo que fortalece al Instituto Nacional de Salud para la prevención y control de las enfermedades, señalan que son funciones rectoras del Ministerio de Salud, formular, planear, dirigir, coordinar, ejecutar, supervisar y evaluar la política nacional y sectorial de promoción de la salud, vigilancia, prevención y control de las enfermedades, recuperación, rehabilitación en salud, tecnologías en salud y buenas prácticas en salud, bajo su competencia, aplicable a todos los niveles de gobierno; así como dictar normas y lineamientos técnicos para la adecuada ejecución y supervisión de la política nacional y políticas sectoriales de salud, entre otras;
Que, la Ley N° 29459, Ley de los Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios, define y establece los principios, normas, criterios y exigencias básicas sobre estos productos y dispositivos de uso en seres humanos, en concordancia con la Política Nacional de Salud y la Política Nacional de Medicamentos;
Que, la Ley N° 29698, Ley que declara de interés nacional y preferente atención el tratamiento de personas que padecen enfermedades raras o huérfanas, declara de interés nacional la prevención, el diagnóstico, la atención integral de salud y la rehabilitación de las personas que padecen enfermedades raras o huérfanas, entendidas éstas como las enfermedades, incluidas las de origen genético, que tienen una frecuencia baja, presentan muchas dificultades para ser diagnosticadas y efectuar su seguimiento, tienen un origen desconocido en la mayoría de los casos que conllevan múltiples problemas sociales y con escasos datos epidemiológicos;
Que, el artículo 9 de la citada Ley, incorporado por la Ley N° 31738, dispone que los productos farmacéuticos que cuentan con registro, aprobación, permiso, autorización o cualquier modo de título habilitante emitido o aprobado en cualquiera de los países de alta vigilancia sanitaria, destinados a la atención integral, incluyendo diagnóstico y tratamiento, de las enfermedades raras o huérfanas, obtienen registro sanitario sin más requisitos técnicos o médicos que la acreditación de dicho registro previo. La información de seguridad y eficacia de los productos farmacéuticos que presenten los titulares es aquella que sustentó el registro correspondiente en el país de alta vigilancia sanitaria. La Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM) resuelve la solicitud de inscripción o reinscripción en el registro sanitario, en un plazo no mayor de cuarenta y cinco (45) días calendario sujeto a silencio administrativo positivo, bajo responsabilidad y sanción del funcionario correspondiente. Este procedimiento puede ser utilizado también para el registro sanitario de productos farmacéuticos para tratamientos oncológicos;
Que, la Primera Disposición Complementaria Final de la Ley N° 31738, Ley que modifica la Ley 29698, Ley que declara de interés nacional y preferente atención el tratamiento de personas que padecen enfermedades raras o huérfanas, dispone que el Poder Ejecutivo realiza las adecuaciones que correspondan en la reglamentación de la Ley N° 29698;
Que, de conformidad con el Decreto Ley N° 25909, concordante con el artículo 4 del Decreto Ley N° 25629, ninguna entidad, con excepción del Ministerio de Economía y Finanzas, puede irrogarse la facultad de dictar medidas destinadas a restringir o impedir el libre flujo de mercancías mediante la imposición de trámites, requisitos o medidas de cualquier naturaleza que afecten las importaciones o exportaciones; por ende, son nulos todos los actos que contravengan esta disposición, debiendo aprobarse dichas disposiciones únicamente mediante Decreto Supremo refrendado por el Ministerio de Economía y Finanzas y por el Sector involucrado;
Que, en consecuencia, resulta necesario establecer las disposiciones referidas al registro sanitario de productos farmacéuticos para el tratamiento de enfermedades raras o huérfanas y al registro sanitario de productos farmacéuticos para tratamientos oncológicos, conforme al artículo 9 de la Ley N° 29698, Ley que declara de interés nacional y preferente atención el tratamiento de personas que padecen de enfermedades raras o huérfanas, incorporado por la Ley N° 31738;
De conformidad con lo establecido en el numeral 8 del artículo 118 de la Constitución Política del Perú; la Ley N° 29158, Ley Orgánica del Poder Ejecutivo; el Decreto Ley N° 25629, que restablece la vigencia del artículo 19 del Decreto Legislativo N° 701 y del artículo 44 del Decreto Legislativo N° 716, derogados por el artículo 2 de la Ley N° 25399; y el Decreto Ley N° 25909, que dispone que ninguna entidad, con excepción del Ministerio de Economía y Finanzas, puede irrogarse la facultad de dictar medidas destinadas a restringir el libre flujo de mercancías tanto en las importaciones como en las exportaciones;
DECRETA:
Artículo 1.- Objeto
El presente Decreto Supremo tiene por objeto establecer las disposiciones referidas al registro sanitario de productos farmacéuticos para el diagnóstico y/o tratamiento de enfermedades raras o huérfanas y al registro sanitario de productos farmacéuticos para tratamientos oncológicos, en el marco de lo dispuesto en el artículo 9 de la Ley N° 29698, Ley que declara de interés nacional y preferente atención el tratamiento de personas que padecen enfermedades raras o huérfanas, incorporado por la Ley N° 31738.
Artículo 2.- Ámbito de aplicación
Se encuentran comprendidos en el presente Decreto Supremo:
a) Los productos farmacéuticos para el diagnóstico y/o tratamiento de enfermedades raras o huérfanas, sobre la base de las enfermedades consideradas en el Listado de Enfermedades Raras o Huérfanas aprobado por el Ministerio de Salud y publicado en su portal web.
b) Los productos farmacéuticos para tratamientos oncológicos cuya indicación de uso está determinada así por la autoridad reguladora del país de alta vigilancia sanitaria (PAVS).
Los productos farmacéuticos señalados en el presente artículo deben contar con registro, aprobación, permiso, autorización o cualquier modo de título habilitante vigente emitido o aprobado en cualquiera de los países de alta vigilancia sanitaria, de acuerdo a lo señalado en el artículo 9 del Reglamento para el Registro, Control y Vigilancia Sanitaria de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios, aprobado por Decreto Supremo N° 016-2011-SA.
Artículo 3.- Aspectos generales sobre los productos comprendidos en el Reglamento
3.1 Los términos “registro”, “aprobación”, “permiso”, “autorización” o cualquier modo de título habilitante, corresponden a la autorización de comercialización que otorgan las autoridades reguladoras de los países de alta vigilancia sanitaria (PAVS), la cual debe acreditar el registro previo del mismo producto farmacéutico en dicho país (misma fórmula cualitativa y cuantitativa, misma cantidad de IFA (expresado en unidad de dosis o concentración), misma forma farmacéutica, mismas indicaciones, misma vía de administración, mismo proceso de manufactura, mismo(s) fabricante(s) que interviene(n) en la manufactura del(los) Ingrediente(s) Farmacéutico(s) Activo(s) – IFA(s) hasta el producto terminado, solvente y/o dispositivos médicos, cuando corresponda, incluyendo los mismos laboratorios que realizan el control de calidad, y misma calidad de todos los excipientes).
3.2 Las condiciones bajo las cuales el país de alta vigilancia sanitaria (PAVS) autoriza el producto farmacéutico deben mantenerse durante la vigencia del registro sanitario otorgado por la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM). Los cambios que han sido autorizados por el PAVS deben efectuarse ante la ANM a través de un cambio en su registro sanitario.
Sólo se aceptan los cambios, posterior al otorgamiento del registro sanitario, que han sido previamente autorizados por el PAVS correspondiente con la documentación que lo sustente, cambios solicitados por la ANM por adecuación a la norma y los cambios administrativos relacionados al titular del registro sanitario a los que hace referencia el literal a) del numeral 1 del artículo 36 del Reglamento para el Registro, Control y Vigilancia Sanitaria de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios, aprobado por Decreto Supremo N° 016-2011-SA.
Artículo 4.- De la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM)
La Dirección General de Medicamentos, Insumos y Drogas (DIGEMID), órgano de línea del Ministerio de Salud, como Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM), está encargada, a nivel nacional, de inscribir, reinscribir, modificar, denegar, suspender o cancelar el registro sanitario de los productos farmacéuticos para el diagnóstico y/o tratamiento de enfermedades raras o huérfanas, y para tratamientos oncológicos a que se refiere el presente Decreto Supremo, así como de realizar el control y vigilancia sanitaria de los mismos, y conducir las acciones de farmacovigilancia correspondientes.
Artículo 5.- Del Documento Técnico Común – CTD
Para los fines de aplicación del presente Decreto Supremo, el Documento Técnico Común (CTD por sus siglas en inglés) es aquel que describe la organización de la información de eficacia, seguridad y calidad en un expediente (dosier) de productos biológicos o medicamentos, el cual está estructurado en módulo 1 (información administrativa), módulo 2 (resúmenes), módulo 3 (calidad), módulo 4 (reporte de estudios preclínicos) y módulo 5 (reporte de estudios clínicos), de acuerdo a lo establecido por el Consejo Internacional para la Armonización de los Requisitos Técnicos de los Productos Farmacéuticos para Uso Humano (ICH).
La Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM) puede aceptar la información con una estructura diferente al CTD, siempre y cuando haya sido autorizada en el PAVS.
La información relacionada al contenido del CTD del módulo 3 (calidad), módulo 4 (estudios preclínicos) y módulo 5 (estudios clínicos) puede ser remitida en idioma inglés. La demás documentación a presentar debe estar acompañada de su respectiva traducción simple al idioma español incluyendo la información del módulo 2 del CTD.
Artículo 6.- Registro sanitario de productos farmacéuticos para el diagnóstico y/o tratamiento de enfermedades raras o huérfanas, y para tratamientos oncológicos
El registro sanitario de un producto farmacéutico para el diagnóstico y/o tratamiento de enfermedades raras o huérfanas, y el registro sanitario de un producto farmacéutico para tratamiento oncológico facultan su fabricación, importación, almacenamiento, distribución, comercialización, dispensación, expendio o uso. El registro sanitario se otorga por nombre, forma farmacéutica, cantidad de Ingrediente Farmacéutico Activo – IFA, fabricante(s) y país(es).
Se otorga certificado de registro sanitario a aquellos productos farmacéuticos con estudios en fase III concluidos, autorizados en el marco de lo dispuesto en el artículo 9 de la Ley N° 29698, modificada por la Ley N° 31738, y el presente Reglamento, siempre que el solicitante cuente con autorización sanitaria como droguería y autorización expresa del titular del registro sanitario, debiendo cumplir con lo señalado en el artículo 26 del Reglamento para el Registro, Control y Vigilancia Sanitaria de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios, aprobado por Decreto Supremo N° 016-2011-SA, con las acciones de farmacovigilancia, según lo señalado en el artículo 13 del presente Decreto Supremo, y respondiendo ante el control y vigilancia sanitaria de los productos farmacéuticos por parte de la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM).
Artículo 7.- Vigencia del registro sanitario de productos farmacéuticos para el diagnóstico y/o tratamiento de enfermedades raras o huérfanas, y para tratamientos oncológicos
El registro sanitario de productos farmacéuticos para el diagnóstico y/o tratamiento de enfermedades raras o huérfanas, y para tratamientos oncológicos, es temporal y renovable cada cinco (05) años, en el marco de lo dispuesto en el artículo 8 de la Ley N° 29459, Ley de los Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios.
Artículo 8.- Requisitos para la inscripción o reinscripción en el registro sanitario de productos farmacéuticos para el diagnóstico y/o tratamiento de enfermedades raras o huérfanas, y tratamientos oncológicos
Para la inscripción o reinscripción en el registro sanitario de productos farmacéuticos para el diagnóstico y/o tratamiento de enfermedades raras o huérfanas, y tratamientos oncológicos, el interesado debe presentar:
1. Solicitud con carácter de declaración jurada que contenga la información detallada en el artículo 9 del presente Decreto Supremo, e incluya número y fecha de la constancia de pago por derecho de trámite;
2. Copia del registro, aprobación, permiso, autorización o cualquier modo de título habilitante emitido o aprobado en cualquiera de los países de alta vigilancia sanitaria (PAVS) que acredite el registro previo del producto farmacéutico en el PAVS;
3. Información de seguridad y eficacia de los productos farmacéuticos con la que se sustentó el registro en el PAVS. Esta información corresponde a los reportes de estudios presentados a la autoridad reguladora de los PAVS correspondiente a los módulos 2 (resumen de la información de eficacia y seguridad), 4 y 5 del CTD.
Artículo 9.- Contenido de la solicitud para la inscripción o reinscripción en el registro sanitario de productos farmacéuticos para el diagnóstico y/o tratamiento de enfermedades raras o huérfanas, y tratamientos oncológicos
Para la inscripción o reinscripción en el registro sanitario de productos farmacéuticos para el diagnóstico y/o tratamiento de enfermedades raras o huérfanas, y tratamientos oncológicos, el interesado debe presentar la correspondiente solicitud con carácter de declaración jurada, según formato establecido por la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM), la que contiene la siguiente información general y técnica:
1. Información general:
a) Objeto de la solicitud (inscripción o reinscripción);
b) Número de registro sanitario y fecha de vencimiento, en caso de reinscripción;
c) Nombre del producto para el cual solicita la inscripción o reinscripción;
d) Clasificación de medicamento o producto biológico, según lo señalado en el artículo 38 o artículo 103 del Reglamento para el Registro, Control y Vigilancia Sanitaria de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios, aprobado por Decreto Supremo N° 016-2011-SA;
e) Nombre o razón social del(los) laboratorio(s) fabricante(s) extranjero(s) que interviene(n) en la manufactura del(los) Ingrediente(s) Farmacéutico(s) Activo(s) – IFA(s) hasta el producto terminado, solvente y/o dispositivos médicos, cuando corresponda, incluyendo los laboratorios que realizan el control de calidad, y detallando la dirección, país de su(s) planta(s) de manufactura y responsabilidades de cada fabricante, tanto para el proceso de manufactura como de control;
f) Nombre comercial o razón social, dirección, Registro Único de Contribuyente (RUC), teléfono, correo electrónico y categoría de la empresa solicitante;
g) Nombre del representante legal y del director técnico;
h) Indicar si opta o no por la vía de la similaridad en el país de alta vigilancia sanitaria (PAVS).
i) Indicación o uso:
(i) Diagnóstico de enfermedades raras o huérfanas;
(ii) Tratamiento de enfermedades raras o huérfanas. Indicar la categoría, sub categoría y patología señalada en el Listado de Enfermedades Raras o Huérfanas aprobado por el Ministerio de Salud.
(iii) Tratamiento de enfermedades oncológicas cuya indicación de uso está determinado así por la autoridad reguladora del país de alta vigilancia sanitaria (PAVS).
j) Listado de países de alta vigilancia sanitaria (PAVS) en los que está autorizado el producto a registrar.
k) Número de la autorización de comercialización otorgada por la autoridad reguladora en el país de alta vigilancia sanitaria (PAVS);
l) En caso de declarar licenciante, consignar su nombre y país.
2. Información técnica:
a) Ingrediente Farmacéutico Activo – IFA(s), forma farmacéutica, cantidad de IFA (expresado en unidad de dosis o concentración) y vía de administración;
b) Denominación Común Internacional (DCI) del(los) IFA(s). En caso el(los) IFA(s) del producto farmacéutico no tenga(n) asignada la DCI, debe consignar el nombre con el que se encuentra en las farmacopeas de referencia o denominación indicada en la ficha técnica de los países de alta vigilancia sanitaria (PAVS) o recomendaciones de la Organización Mundial de la Salud (OMS);
c) Grupo terapéutico y código según el sistema de clasificación ATC (Anatomical Therapeutic Chemical);
d) Condición de venta;
e) Forma de presentación, detallando el tipo y material del envase mediato e inmediato del producto, disolvente, dispositivo(s) médico(s) y accesorio(s), cuando corresponda, y color del(los) envase(s) inmediato(s). De contener aguja(s), detallar la longitud y calibre;
f) Especificaciones técnicas del IFA, producto terminado, disolvente o dispositivo médico, en caso de productos farmacéuticos que estén acompañados de disolventes (diluyentes de reconstitución) o dispositivos médicos;
g) Fórmula cualitativa y cuantitativa: La fórmula cualitativa y cuantitativa expresada en unidades de peso o volumen del sistema métrico decimal o en unidades internacionales, o en unidades de actividad biológica o de contenido proteico, según el tipo de producto que se trate, incluyendo todos los excipientes y disolventes, aunque estos últimos desaparezcan en el proceso de fabricación, señalando la norma técnica de referencia del IFA, excipientes y producto terminado, así como su función. Incluir la fórmula del disolvente o diluyente utilizado para la reconstitución, cuando corresponda, señalando la norma técnica de referencia, así como su función. En caso de cápsula, se debe indicar la composición cualitativa como mínimo (cápsula vacía) y el peso total. Cuando el excipiente se haya autorizado en el país de alta vigilancia sanitaria (PAVS) consignar el nombre con Denominación Común Internacional (DCI), o en su defecto el nombre con el que figura en la farmacopea o nombre químico o nombre de marca;
h) Tiempo de vida útil del producto terminado, disolvente/diluyente y/o dispositivo médico, si lo tuviera;
i) Condiciones de almacenamiento;
j) Sistema de numeración de lotes del producto terminado y del disolvente/diluyente y/o dispositivo médico, cuando corresponda;
k) Vía de administración;
l) Sistema envase cierre:
– Envase inmediato: Tipo, material y color;
– Envase mediato: Tipo, material y color, cuando corresponda;
Para el tipo de envase se debe señalar si se trata de caja, blíster, vial, ampolla, entre otros, según corresponda. Para el material del envase señalar si se trata de cartón, cartulina, vidrio tipo I o II o III, si es de polietileno o poliestireno o aluminio o celofán o aluminio polietileno, entre otros, según corresponda;
m) Número del certificado de Buenas Prácticas de Manufactura (o número del documento considerado equivalente o número del documento que acredite el cumplimiento de normas de calidad para el caso de dispositivo médico), nombre y país de la autoridad reguladora que lo emite, correspondiente al (los) fabricante(s) que interviene(n) en la manufactura del(los) IFA(s) hasta el producto terminado, incluyendo del disolvente y dispositivo médico, cuando corresponda;
n) Contenido de la ficha técnica e inserto autorizado en el PAVS (información que se alcanza traducida al idioma español);
o) Contenido de los rotulados del envase mediato e inmediato autorizado en el PAVS (información que se alcanza traducida al idioma español).
Artículo 10.- Plazos de evaluación y calificación para la inscripción o reinscripción en el registro sanitario de productos farmacéuticos para el diagnóstico y/o tratamiento de enfermedades raras o huérfanas, y tratamientos oncológicos
La Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM), en un plazo no mayor de cuarenta y cinco (45) días calendario a partir de la recepción de la solicitud, aprueba o deniega la solicitud de inscripción o reinscripción en el registro sanitario de productos farmacéuticos para el diagnóstico y/o tratamiento de enfermedades raras o huérfanas, y tratamientos oncológicos. La solicitud de inscripción o reinscripción para el registro sanitario es un procedimiento de evaluación previa sujeto a silencio administrativo positivo, bajo responsabilidad y sanción del funcionario correspondiente.
Artículo 11.- De la información requerida por la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM) para efectuar el control y vigilancia sanitaria de los productos farmacéuticos para el diagnóstico y/o tratamiento de enfermedades raras o huérfanas, y tratamientos oncológicos en el mercado nacional
11.1 A efecto de realizar el control y vigilancia sanitaria de los productos farmacéuticos a los cuales se les ha otorgado registro sanitario en las condiciones señaladas en el presente Decreto Supremo, el titular del registro sanitario, en un plazo de hasta cuarenta y cinco (45) días calendario, contados a partir de la obtención y/o renovación del registro sanitario, debe remitir a la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM):
1. Información de calidad conforme al CTD correspondiente a los módulos 2 (resumen de la información relacionada a la calidad) y 3, presentados a la autoridad reguladora del país de alta vigilancia sanitaria (PAVS) que emite el documento señalado en el numeral 2 del artículo 8 del presente Decreto Supremo. En referencia al estudio de estabilidad, de no corresponder a la zona climática IV A, debe realizar la adecuación de acuerdo a la normatividad correspondiente en un plazo debidamente sustentado por el titular del registro sanitario y evaluado por la ANM;
2. Información del análisis de evaluación para la autorización del producto farmacéutico, procedente de la autoridad reguladora del país de alta vigilancia sanitaria (PAVS) que emite el documento señalado en el numeral 2 del artículo 8 del presente Decreto Supremo, en el caso que la citada información no se encuentre públicamente disponible;
3. Información contenida en la carta de obligaciones específicas, incluyendo la justificación respecto a la información y/o documentación no presentada, así como el plan o cronograma de cumplimiento, todos ellos autorizados por la autoridad reguladora del país de alta vigilancia sanitaria (PAVS), entendiéndose por carta de obligaciones específicas al documento donde se detallan los compromisos para realizar actividades posteriores a la emisión de la autorización del producto farmacéutico, relacionadas con la calidad, eficacia y seguridad del producto;
4. Información contenida en el Plan de Gestión de Riesgo.
5. Información de la ficha técnica, inserto y rotulados tal como se va a comercializar, distribuir o usar en el país, los mismos que deben adecuarse a las disposiciones señaladas en el Reglamento para el Registro, Control y Vigilancia Sanitaria de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios, aprobado por Decreto Supremo N° 016-2011-SA. Excepcionalmente, la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM) puede aceptar el mismo rotulado inmediato autorizado en el país de alta vigilancia sanitaria (PAVS) que emite el documento señalado en el numeral 2 del artículo 8 del presente Decreto Supremo, para lo cual debe adjuntar su traducción correspondiente en idioma español.
Además, para los casos de productos biológicos: Vacunas y derivados de plasma humano, los que están sujetos a liberación de lote por la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM), el titular del registro sanitario debe remitir a la ANM la siguiente documentación:
a) Copia del certificado de liberación de lote emitido por la autoridad competente del país de alta vigilancia sanitaria (PAVS). En el caso que la autoridad competente no emita el referido documento, éste debe justificarse con evidencia procedente de la misma autoridad competente del PAVS;
b) Copia del protocolo resumido de producción y control de lote. En caso no se cuente con lotes fabricados, el titular del registro sanitario puede presentar el formato del protocolo resumido de producción y control de lote del producto elaborado por el fabricante, y posteriormente, a través de un cambio en el registro sanitario, debe presentar el protocolo antes de la liberación del primer lote en el país. Cuando la documentación señalada se encuentre incluida como obligación específica en la carta de obligaciones específicas señalada en el subnumeral 3 del numeral 11.1 del presente artículo, el titular del registro sanitario o del certificado de registro sanitario solicita la autorización excepcional para la liberación de lote a la ANM según lo dispuesto en el artículo 15 del presente Decreto Supremo.
Si el titular del registro sanitario no remite la información y la documentación antes mencionada en el plazo señalado, se procede a la suspensión del registro sanitario, como medida de seguridad sanitaria, por un periodo de ciento veinte (120) días calendario, suspensión que puede ser levantada si se remite la información y documentación referidas. Transcurrido el plazo de ciento veinte (120) días calendario, si no han remitido la información y/o documentación indicada, se procede a cancelar el registro sanitario. Estas medidas también se aplican a los titulares del certificado de registro sanitario de productos farmacéuticos con estudios en fase III concluidos.
11.2 La información y/o documentación a cuya entrega se comprometió el titular del registro sanitario en la carta de obligaciones específicas, a la que se hace referencia en el subnumeral 3 del numeral 11.1 del presente artículo, debe ser presentada ante la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM), y estar conforme a lo autorizado en el PAVS. En caso fortuito o de fuerza mayor que no permita cumplir con alguna de las obligaciones específicas asumidas en la inscripción o reinscripción, se debe adjuntar la justificación correspondiente para su evaluación; caso contrario, se procede a la suspensión del registro sanitario, como medida de seguridad sanitaria.
11.3 De encontrarse evidencias que la información y documentación presentada ante la ANM, a la que se hace referencia en el presente artículo y en el artículo 8 del presente Decreto Supremo, difiere de lo autorizado en el PAVS, se procede a notificar al titular del registro sanitario, a efectos que subsane las observaciones en un plazo de treinta (30) días hábiles. En el caso de no subsanar en el plazo señalado, se procede a la cancelación del registro sanitario.
11.4 El titular del registro sanitario de productos farmacéuticos para el diagnóstico y/o tratamiento de enfermedades raras o huérfanas, y para tratamientos oncológicos, previamente a solicitar cambios en el registro sanitario ante la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM), con excepción de los cambios administrativos mencionados en el artículo 3 del presente Decreto Supremo, debe haber presentado la información y documentación señalada en el numeral 11.1 del presente artículo.
Artículo 12.- Productos farmacéuticos que se encuentren autorizados en un país de alta vigilancia sanitaria con estudios clínicos como mínimo en fase II
Para el caso de productos farmacéuticos cuya indicación corresponda al diagnóstico y/o tratamiento de enfermedades raras o huérfanas, y para tratamientos oncológicos, que se encuentren autorizados en un país de alta vigilancia sanitaria con estudios clínicos como mínimo en fase II, una vez obtenido el registro sanitario en el marco de lo dispuesto en el presente Decreto Supremo, el titular debe remitir a la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM), dentro de cada año, contado desde el otorgamiento del referido registro, la información de seguridad y eficacia disponible de los estudios clínicos nuevos o en curso presentados al obtener el registro sanitario, así como la información actualizada de seguridad del plan de gestión de riesgo; ello a efectos de permitir la evaluación actual del beneficio riesgo positivo. Para las sucesivas reinscripciones, el titular del registro sanitario debe remitir a la ANM, dentro de cada año, contado desde la renovación del referido registro, la información antes señalada debidamente actualizada, hasta la culminación del estudio clínico en fase III, cuando corresponda. Si los nuevos datos alcanzados por el titular del registro sanitario muestran que los beneficios del referido producto farmacéutico ya no superan sus riesgos, esto da lugar a la aplicación de las medidas de seguridad correspondientes. Si el titular del registro sanitario no presenta la información mencionada en los plazos señalados, se procede a la suspensión del registro sanitario, como medida de seguridad sanitaria.
Artículo 13.- De la farmacovigilancia
Los titulares del registro sanitario o del certificado de registro sanitario de productos farmacéuticos regulados por el presente Decreto Supremo están obligados a cumplir con el Manual de Buenas Prácticas de Farmacovigilancia, sus modificatorias y demás normativa vigente sobre la materia.
Artículo 14.- Del certificado de liberación de lote
A partir de la autorización del registro sanitario de productos farmacéuticos para el diagnóstico y/o tratamiento de enfermedades raras o huérfanas, y tratamientos oncológicos, el titular del registro sanitario o del certificado de registro sanitario está obligado a solicitar el Certificado de liberación de cada lote de la vacuna o derivado de plasma humano antes de su distribución o comercialización o uso, excepto para el caso señalado en el artículo 15 del presente Decreto Supremo.
El titular del registro sanitario, previo a solicitar el certificado de liberación de lote, debe haber presentado la documentación detallada en los literales a) y b) del numeral 11.1 del artículo 11 del presente Decreto Supremo. Para que el titular del certificado de registro sanitario solicite el certificado de liberación de lote, previamente la ANM debe contar con la documentación antes señalada presentada por el titular del registro sanitario.
La Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM) expide el certificado de liberación de lote según lo establecido en el Reglamento que regula la expedición del certificado de liberación de lote de productos biológicos: vacunas o derivados de plasma humano, aprobado por Decreto Supremo N° 016-2018-SA, o norma que haga sus veces.
Artículo 15.- Autorización excepcional para la liberación de lote
Durante la vigencia del registro sanitario, la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM) autoriza la distribución o uso o comercialización de vacunas o derivados de plasma humano sin expedición del certificado de liberación de lote emitido por dicha Autoridad, en casos de situaciones de urgencia o emergencia declarada en el país, y situaciones de salud pública, según lo establecido en el artículo 14 del Reglamento que regula la expedición del certificado de liberación de lote de productos biológicos: vacunas o derivados de plasma humano, aprobado por Decreto Supremo N° 016-2018-SA, o norma que haga sus veces.
En los casos que, en la carta de obligaciones específicas a la que se hace referencia en el subnumeral 3 del numeral 11.1 del artículo 11 del presente Decreto Supremo, se haya señalado como compromiso la presentación posterior del formato del protocolo resumido de fabricación y control de lote del producto, el titular del registro sanitario o del certificado de registro sanitario solicita la autorización excepcional para la liberación de lote, presentando la información a que se refiere el artículo 37 del Reglamento para el Registro Sanitario Condicional de Medicamentos y Productos Biológicos, aprobado por Decreto Supremo N° 020-2023-SA, o norma que lo reemplace.
Artículo 16.- Del rotulado, ficha técnica e inserto
Los rotulados, ficha técnica e inserto, en idioma español, son publicados en el portal de la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM).
Artículo 17.- De la comunicación de suspensión, cancelación, retención y retiro del registro correspondiente en el país de alta vigilancia sanitaria
El titular de registro sanitario de productos farmacéuticos para el diagnóstico y/o tratamiento de enfermedades raras o huérfanas, y para tratamientos oncológicos, debe comunicar a la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM) la suspensión, cancelación, retención o retiro del registro correspondiente en el país de alta vigilancia sanitaria (PAVS).
Procede la suspensión o cancelación del registro sanitario y certificado de registro sanitario por la ANM cuando la autoridad reguladora del PAVS que emite el documento señalado en el numeral 2 del artículo 8 del presente Decreto Supremo ha suspendido, cancelado, retenido o retirado el registro correspondiente en dicho país.
Artículo 18.- Publicación
El presente Decreto Supremo se publica en la Plataforma Digital Única del Estado Peruano para Orientación al Ciudadano (www.peru.gob.pe), así como en las sedes digitales de las entidades cuyos titulares lo refrendan, el mismo día de su publicación en el Diario Oficial El Peruano.
Artículo 19.- Refrendo
El presente Decreto Supremo es refrendado por el Ministro de Economía y Finanzas y por el Ministro de Salud.
DISPOSICIONES COMPLEMENTARIAS FINALES
Primera.- Aspectos no regulados
Los aspectos no regulados en el presente Decreto Supremo se rigen por las disposiciones contenidas en la Ley N° 29459, Ley de los Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios; el Reglamento para el Registro, Control y Vigilancia Sanitaria de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios, aprobado con Decreto Supremo N° 016-2011-SA; el Reglamento de Establecimientos Farmacéuticos, aprobado con Decreto Supremo N° 014-2011-SA; y por el Reglamento que regula la expedición del certificado de liberación de lote de productos biológicos: vacunas o derivados de plasma humano, aprobado por Decreto Supremo N° 016-2018-SA.
Segunda.- Productos farmacéuticos que han obtenido su registro sanitario en el marco de lo dispuesto en la Ley N° 29459, Ley de los Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios, y su respectivo Reglamento
Los productos farmacéuticos cuya indicación corresponda al diagnóstico y/o tratamiento de enfermedades raras o huérfanas, y tratamientos oncológicos a los cuales se les ha otorgado registro sanitario conforme a lo dispuesto en la Ley N° 29459, Ley de los Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios, y en el Reglamento para el Registro, Control y Vigilancia Sanitaria de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios, aprobado con Decreto Supremo N° 016-2011-SA, deben cumplir las disposiciones de la referida normatividad durante la vigencia del registro sanitario concedido.
Los productos farmacéuticos enmarcados en el artículo 2 del presente Decreto Supremo, que han obtenido su registro sanitario en el marco de lo dispuesto en la normatividad antes mencionada, pueden acogerse a lo dispuesto en el presente Decreto Supremo, para su siguiente reinscripción.
Tercera.- Vigencia
El presente Decreto Supremo entra en vigencia a los seis (6) meses contados a partir del día siguiente de su publicación en el Diario Oficial El Peruano.
DISPOSICIONES COMPLEMENTARIAS TRANSITORIAS
Primera.- Procedimientos en trámite
Los procedimientos administrativos iniciados antes de la entrada en vigencia del artículo 9 de la Ley N° 29698, incorporado por la Ley N° 31738, se rigen por lo dispuesto en el Reglamento aprobado por Decreto Supremo N° 016-2011-SA hasta su conclusión, sin perjuicio del derecho del solicitante a desistirse del procedimiento para adecuarse a lo previsto en el presente Decreto Supremo.
Segunda.- Productos farmacéuticos que han obtenido su registro sanitario en el marco de lo dispuesto en el artículo 9 de la Ley N° 29698, modificada por la Ley N° 31738, y antes de la entrada en vigencia del presente Decreto Supremo
Los productos farmacéuticos que han obtenido su registro sanitario en el marco de lo dispuesto en el artículo 9 de la Ley N° 29698, incorporado por la Ley N° 31738, y antes de la entrada en vigencia del presente Decreto Supremo, deben cumplir con lo dispuesto en el presente Decreto Supremo, debiendo el titular del registro sanitario remitir, dentro del plazo de cuarenta y cinco (45) días calendario, contados a partir de la entrada en vigencia del presente Decreto Supremo, la información y documentación señalada en sus artículos 8 y 11. Si el titular del registro sanitario no remite la información y la documentación antes mencionada en el plazo señalado, se procede a la suspensión del registro sanitario, como medida de seguridad sanitaria.
De encontrarse evidencias que la información y documentación presentada ante la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM), a la que se hace referencia en los artículos 8 y 11 del presente Decreto Supremo, difiere de lo autorizado en el país de alta vigilancia sanitaria (PAVS), se procede a notificar al titular del registro sanitario a efectos que subsane las observaciones en un plazo de treinta (30) días hábiles. En el caso de no subsanar en el plazo señalado se procede a la cancelación del registro sanitario.
Dado en la Casa de Gobierno, en Lima, a los once días del mes de abril del año dos mil veinticinco.
DINA ERCILIA BOLUARTE ZEGARRA
Presidenta de la República
JOSÉ ANTONIO SALARDI RODRÍGUEZ
Ministro de Economía y Finanzas
CÉSAR HENRY VÁSQUEZ SÁNCHEZ
Ministro de Salud

![El Tribunal Superior puede volver a valorar la prueba personal actuada en primera instancia, pero está supeditado a que haya sido entendida o apreciada con manifiesto error o de modo radicalmente inexacto, o que haya sido desvirtuada por pruebas practicadas en segunda instancia [Casación 1045-2022, Arequipa, f. j. 21]](https://img.lpderecho.pe/wp-content/uploads/2025/10/MAZO-ESPOSAS-LIBROS-LPDERECHO-218x150.jpg)
![La exclusión de beneficio de reducción prudencial por responsabilidad restringida en los delitos contra la libertad sexual colisiona con el principio de igualdad ante la ley [Casación 2247-2022, Ica, f. j. 16]](https://img.lpderecho.pe/wp-content/uploads/2025/07/MAZO-BALANZA3-LPDERECHO-218x150.jpg)

![Basta la existencia del adeudo contenido en una resolución administrativa (objeto de cumplimiento) para que surja el deber legal de abonar intereses [Pleno Jurisdiccional Nacional Constitucional y Procesal Constitucional, 2023, p. 33]](https://img.lpderecho.pe/wp-content/uploads/2025/10/ADEUDO-RESOLUCION-ADMINISTRATIVA-LPDERECHO-218x150.jpg)
![Criterios del «test de referencia» para evaluar la veracidad de la declaración de la víctima: seguridad, concreción, claridad expositiva, seriedad expositiva —ausencia de fabulaciones—, expresividad descriptiva, ausencia de contradicción y concordancia del iter relatado, ausencia de lagunas, declaración no fragmentada y relato íntegro [Casación 940-2023, Loreto, f. j. 6]](https://img.lpderecho.pe/wp-content/uploads/2025/07/MAZO-TRIBUNAL-LPDERECHO-218x150.jpg)

![Ley Orgánica del Registro Nacional de Identificación y Estado Civil (Ley 26497) [actualizada 2025]](https://img.lpderecho.pe/wp-content/uploads/2025/05/Ley-organica-del-registro-nacional-de-identificacion-y-estado-civil1-LPDERECHO-218x150.jpg)













![Los daños y perjuicios por incumplimiento de obligaciones laborales solo proceden si se prueban los elementos de la responsabilidad civil [Casación 19186-2024, Callao]](https://img.lpderecho.pe/wp-content/uploads/2024/11/contratacion-irregular-de-un-trabajador-LPDERECHO-218x150.jpg)
![El aumento por extensión de la jornada laboral es remunerativo aunque no se haya pactado como básico [Cas. Lab. 6535-2023, Callao]](https://img.lpderecho.pe/wp-content/uploads/2024/04/laboral-horas-extras-sobretiempo-sobre-tiempo-trabajo-LPDerecho-218x150.jpg)


![Crean el Observatorio del Servicio Civil [Resolución 000027-2026-Servir-PE]](https://img.lpderecho.pe/wp-content/uploads/2025/03/SERVIR-3-LPDERECHO-218x150.jpg)
![MTC fija especificaciones técnicas para placas de motos [Resolución Directoral 006-2026-MTC/18]](https://img.lpderecho.pe/wp-content/uploads/2024/11/delivery-moto-lineal-LPDERECHO-218x150.jpg)
![Aprueban el plan nacional de control 2026 [Resolución de Contraloría 104-2026-CG]](https://img.lpderecho.pe/wp-content/uploads/2024/03/la-contraloria-LPDerecho-218x150.jpg)
![Ley de Delitos Informáticos (Ley 30096) [actualizada]](https://img.lpderecho.pe/wp-content/uploads/2024/08/ley-de-delitos-informaticos-ley-30096-actualizada-LPDERECHO-218x150.jpg)
![Código Penal peruano [actualizado 2026]](https://img.lpderecho.pe/wp-content/uploads/2024/05/VENTA-CODIGO-PENAL-LPDERECHO-218x150.jpg)
![Código Procesal Penal peruano [actualizado 2026]](https://img.lpderecho.pe/wp-content/uploads/2024/02/VENTA-CODIGO-PENAL-BANNER-POST-TAPA-DURA-LPDERECHO-218x150.jpg)
![TUO del Reglamento General de los Registros Públicos (Resolución 126-2012-Sunarp-SN) [actualizado 2026]](https://img.lpderecho.pe/wp-content/uploads/2026/02/TUO-del-Reglamento-general-registros-publicos-LPDerecho-218x150.png)
![Decreto Legislativo del Notariado (Decreto Legislativo 1049) [actualizado 2026]](https://img.lpderecho.pe/wp-content/uploads/2026/02/BANNER-REGLAMENTO-NOTARIAL2-218x150.jpg)









![[VÍDEO] ¿Quieres postular a la Fiscalía? Estas son las preguntas que hacen en las entrevistas](https://img.lpderecho.pe/wp-content/uploads/2021/10/postular-fiscalia-preguntas-entrevista-LP-218x150.jpg)




![Corte IDH condena al Perú por demora injustificada e innecesaria en la ejecución de decisiones judiciales en agravio de un jubilado [caso Cuadra Bravo vs. Perú]](https://img.lpderecho.pe/wp-content/uploads/2025/05/Corte-IDH-fachada-LPDerecho-324x160.jpg)



![Código Penal peruano [actualizado 2026]](https://img.lpderecho.pe/wp-content/uploads/2024/05/VENTA-CODIGO-PENAL-LPDERECHO-100x70.jpg)


![Basta la existencia del adeudo contenido en una resolución administrativa (objeto de cumplimiento) para que surja el deber legal de abonar intereses [Pleno Jurisdiccional Nacional Constitucional y Procesal Constitucional, 2023, p. 33]](https://img.lpderecho.pe/wp-content/uploads/2025/10/ADEUDO-RESOLUCION-ADMINISTRATIVA-LPDERECHO-100x70.jpg)

![Corte IDH condena al Perú por demora injustificada e innecesaria en la ejecución de decisiones judiciales en agravio de un jubilado [caso Cuadra Bravo vs. Perú]](https://img.lpderecho.pe/wp-content/uploads/2025/05/Corte-IDH-fachada-LPDerecho-100x70.jpg)





![Nueva conformación de las salas superiores de la Corte de Lima 2022 [RA 000001-2022-P-CSJLI-PJ] orte Superior de Justicia de Lima](https://img.lpderecho.pe/wp-content/uploads/2021/12/Corte-Superior-de-Justicia-de-Lima-LPDerecho-324x160.jpg)